阜阳一中本部高三第三次月考化学试题
命题: 胡利平 审题: 李 冰 2006/12/30
一. 选择题(3×20=60分,每小题只有一个选项符合题意)
1.2006年意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它存在的证据。若该氧分子具有空间对称结构,下列关该氧分子的说法正确的是 ( )
A.是一种新的氧化物 B.不可能含有极性键
C.是氧元素的一种同位素 D.是臭氧的同分异构体
2.某城市以“液氯泄漏”作为应急预警演习的项目,演习时下列防护措施合理的是( )
①及时向上风口和地势较高处转移疏散人群;②及时戴上用浓烧碱溶液湿润过的口罩;
③用高压水枪向泄露口附近喷洒稀碱液并设法控制氯气泄漏;④及时戴上用稀纯碱溶液湿润过的口罩;⑤及时用毛巾包裹活性炭捂住口鼻;⑥就近向地下商场转移。
A.②③④⑤ B.①②④⑤ C.①③④⑤ D.①③④⑥
3.设阿伏加德常数为NA。则下列说法正确的是 ( )
A 常温常压下,11.2L甲烷中含有的氢原子数为2NA
B 标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA
C 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D 常温下,1L 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA
4.以下实验装置一般不用于分离物质的是 ( )
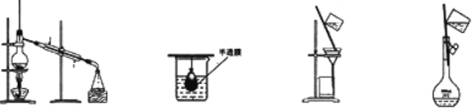
A B C D
5.X、Y均为周期表中短周期元素,X原子的最外层电子数是Y原子的最外层电子数的6倍,它们能彼此形成的化合物可以满足2个或8个电子的稳定结构,下列说法不正确的是 ( )
A.X、Y形成的化合物的分子式一定为Y2X
B.X与Y形成的化合物可能具有强氧化性
C.X可能在第三周期,Y在第二周期
D. X、Y形成的化合物可能使溴水褪色
6. 已知氯化铁溶液中通入硫化氢可发生反应:2FeCl3+H2S→2FeCl2+S↓+2HCl。在标准状况下,向100mLFeCl3溶液中通入a L的H2S气体恰好反应后,再加入足量的铁粉充分反应。所得溶液经测定金属阳离子的浓度为3mol/L,若反应过程中溶液体积不变,则原FeCl3溶液的物质的量浓度为( )
A.1.5mol/L B.1 mol/L C.2 mol/L D.无法确定
7. 下列各组物质的类别归属正确的是 ( )
A. 同位素: 1H2、2H2、3H2 B. 非电解质:Cl2、BaSO4、C2H5OH
C. 分子晶体: I2、SO3、固态氩 D. 纯净物: 重水、双氧水、矿泉水
8.下列关于卤素的叙述中正确的是 ( )
①卤素的钾盐中,最易被氧化的氟化钾:②溴中溶有少量氯气,可以用加入溴
化钠再用汽油萃取的方法提纯;③溴化银具有感光性,碘化银不具感光性;④某溶液与淀粉碘化钾溶液反应出现蓝色,则证明该溶液是氯水或溴水;⑤氟气跟氯化钠水溶液反应,一定有HF和O2生成;⑥氯气跟水反应时,水既不是氧化剂也不是还原剂。
(A)①③⑤ (B)②④⑥ (C)②⑤⑥ (D)①③④
9.将3mol A 和2.5mol B 充入容积为2L的密闭容器中,发生如下反应:
3A(气) + B(气) ![]() nC(气) + 2D(气),经测定,5min后反应达平衡状态,生成1mol D,
v(C)=0.1 mol·L-1·min-1 ,下列结论中错误的是
( )
nC(气) + 2D(气),经测定,5min后反应达平衡状态,生成1mol D,
v(C)=0.1 mol·L-1·min-1 ,下列结论中错误的是
( )
① 平衡时B的转化率为20% ② 平衡时B的浓度为1mol·L-1
③ 经计算,n值为1 ④ v(A) = 0.3 mol·L-1·min-1
(A) ①、② (B) ①、④ (C) ②、③ (D) ③、④
10.t℃时,将一定质量的某物质的不饱和溶液均分为三份,分别加热蒸发溶液,然后把温度降至t℃,已知从三份溶液中蒸发的溶剂质量分别为10g、20g、30g,析出晶体(不含结晶水)质量分别为a、b、c(单位g,且a、b、c均大于零),则a、b、 c三者的关系为 ( )
A、c=2b-a B、c=a+b C、c=a+2b D、c=2a+b
11、在试管中注入某红色溶液,给试管加热,溶液颜色逐渐变浅,则原溶液可能是:
①滴有石蕊的CO2溶液 ②滴有石蕊的NH4Cl溶液 ③滴有石蕊的H2SO4溶液
④滴有酚酞的氨水溶液 ⑤滴有酚酞的氢氧化钠溶液 ⑥滴有酚酞的饱和氢氧化钙溶液
⑦滴有酚酞的Na2CO3溶液 ⑧Fe (SCN)3溶液 ⑨溶有SO2的品红溶液
A、①④⑥ B、③⑤⑦⑧ C、④⑥ D、②④⑥⑨
12.叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是 ( )
A HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3)>c(OH)
B HN3与NH3作用生成的叠氮酸铵是共价化合物
C NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+)
D N3-与CO2含相等电子数
13、为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加Ag NO3溶液,产生白色沉淀。根据实验以下推测正确的是 ( )
A 一定有SO32-离子 B 不一定有CO32-离子
C 不能确定Cl-离子是否存在 D 不能确定HCO3-离子是否存在
14.下列说法正确的是 ( )
A.200 mL,1 mol/L Al2(SO4)3溶液中,Al3+ 和SO42—离子总数为6.02×1023
B.标准状况下,22.4 L Cl2和HCl的混合气体中含分子总数为2×6.02×1023
C.30 g甲醛中含共用电子对总数为4×6.02×1023
D.0.1 mol 8135Br原子中含中子数为3.5×6.02×1023
15.已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是 ( )
 A.a—b时沉淀的物质的量:A1(OH)3比BaSO4多
A.a—b时沉淀的物质的量:A1(OH)3比BaSO4多
B.c—d时溶液中离子的物质的量:AlO2-比Ba2+少
C.a—d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D.d—e时溶液中离子的物质的量:Ba2+可能等于OH-
16.下列离子方程式书写正确的是 ( )
A.用湿润的醋酸铅试纸检验硫化氢:H2S + Pb2+ = PbS↓ + 2H+
B.将标准状况下112mL氯气通入10mL浓度为1mol·L-1的溴化亚铁溶液中:
2Fe 2++4Br-+3Cl2=3Fe3++6Cl-+2Br2
C.次氯酸钙溶液中通入过量二氧化碳:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO
D.氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
17.为了确定某物质是否变质,所选试剂(括号内物质)达不到实验要求的是 ( )
A.K2SO3是否被氧化(BaCl2) B.FeSO4是否被氧化(KSCN)
C.KI是否被氧化(淀粉溶液) D.漂粉精是否变质(盐酸)
18、铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢 氧化钠溶液,生成沉淀的质量为( )
A、9.02g B、8.51g C、8.26g D、7.04g
19、某无色气体可能由O2、CO2、HCl、NH3、NO、Br2中的一 种或几种组成,通过图中洗气瓶后气体体积减小,通过干燥管后气体呈红棕色,则下列推断正确的是
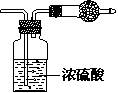 A.干燥管内固体为碱石灰
A.干燥管内固体为碱石灰
B.原气体中一定有NO和O2
C.原气体中一定有NH3、NO、CO2
D.原气体中一定没有HCl、Br2、CO2
20.判断下列有关硒的叙述不正确的是 ( )
①硒化氢比硫化氢稳定②硒在空气中燃烧生成SeO2, 和钠反应生成Na2Se
③硒化氢在空气中不能燃烧 ④ SeO2既有氧化性又有还原性
⑤SeO2可被NaOH溶液吸收 ⑥Cu+Se=CuSe ⑦H2Se通入SO2溶液中,无明显现象
A.只有① B。只有①⑤⑥ C。只有①③⑥ D。只有①③⑥⑦
二.填空题
21、(8分)已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01mol·L—1的碘酸(HIO3)或高锰酸(HMnO4)溶
液与pH =12的NaOH溶液等体积混合,所得混合液显中性。请回答下列问题:
(1)高碘酸是 (填“强酸”或“弱酸”),理由是 。
(2)已知高碘酸和硫酸锰(MnSO4)在溶液中反应生成高锰酸、碘酸和硫酸,此反应的氧化剂是 ,反应的离子方程式可表示为:
22.(6分)NaHSO4是一种酸式盐,
(1)NaHSO4晶体熔化时的电离方程式
(2)0.1mol/l NaHSO4溶液的PH=
(3)NaHSO4溶液与NaHSO3溶液反应的离子方程式
23.(10分)下图表示各物质之间的转化关系。已知:A、B、I都是XY2型化合物,且阳离子相同,A、B晶体中阴、阳离子个数比都是1∶1,但I晶体中阴、阳离子个数比是2∶1,I常用作干燥剂。请按要求填空:
⑴G的电子式是_______________;
⑵反应⑥的化学方程式是__________________________________,反应⑤在空气中发生时的现象是___________________________,已知C的燃烧热是1300 kJ·mol-1,表示C的燃烧热的热化学方程式是________________________________________。
⑶根据上图中物质之间的转化关系及题中所给信息判断,B的化学式是_________。
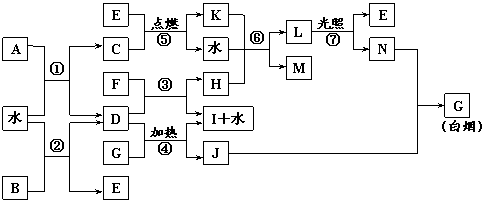 |
24.(6分)某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、Mn4-、CO32-、SO42-中的若干种组成,取该溶液进行如下实验:
(A)取适量试液,加入过量盐酸,有气体生成,并得到溶液;
(B)在(A)所得溶液中再加入过量碳酸氢铵溶液。有气体生成;同时析出白色沉淀甲;
(c)在(B)所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是_______(2)一定存在的离子是_________________;
(3)判断沉淀乙成份的方法是_________________________________________。
三.计算
25.(10分)已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓HCl成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分解:PbO2—Pb2O3---Pb3O4—PbO
现将amolPbO2加热分解,收集产生的O2;向加热后所得固体中加入足量的浓盐酸, 收集产生的Cl2.加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;两步反应中收集的O2和Cl2的物质的量之和为ymol.试回答下列问题:
(1) 试写出Pb2O3与浓盐酸反应的化学方程式.
(2) 通过计算确定y与a、x的函数关系式
(3) 若两步反应中O2和Cl2的物质的量之比为5:3,则剩余固体中含有的物质为
其物质的量之比为
阜阳一中东校高三第三次月考化学答题卷
一.选择(60分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | | | | | | | | | | | | | | | | | | | | |
二.填空(30分)
21.(1)
(2)
22.(1)
(2)
(3)
23.(1)
(2)
(3)
24.(1) (2) (3)
25.(1)
(2)
(3)
阜阳一中高三第三次月考化学答案
一.选择(60分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | C | C | D | D | C | C | C | A | A | C | B | C | C | C | D | A | B | C | D |
二.填空(30分)
21.(8分)(1)弱酸(2分)由于高碘酸溶液的c(H+)与NaOH溶液的c(OH—)相等,二者等体积混合后,混合液显酸性,说明酸过量,原高碘酸溶液中只有一部分高碘酸的分子发生了电离,所以高碘酸是弱酸(2分) (共3分)
(2)高碘酸(2分),5H5IO6+2Mn2+ 2MnO4—+5IO3—+7H2O+11H+(2分)
22.(6分)(1)NaHSO4=Na++HSO4- (2)1 (3)H++HSO3-=H2O+SO2↑
23.(10分)(1)![]() ;
;
⑵Ca(ClO)2+CO2+H2O=CaCO3+2HClO,火焰明亮并伴有浓烈黑烟,
C2H2(g)+5/2O2(g)→2CO2(g)+H2O(l);ΔH=-1300 kJ·mol-1 ⑶CaO2 。
(共6分)
24.(6分)(1)Ag+、Ba2+、Al3+、MnO4-(2分)
(2)Na+、AlO2-、CO32-(2分) (3)加入盐酸,观察沉淀是否全部溶解(2分)
三.计算
25.(10分)(1)Pb2O3+6HCl(浓)=2PbCl2+Cl2↑+3H2O
(2)根据题意:分解所得混合物中n(Pb2+)=ax mol n(Pb4+)=a(1-x )mol
据电子守恒:n(O2)=ax/2mol n(Cl2)=a(1-x )mol
y=n(O2)+n(Cl2)=ax/2mol+a(1-x)mol=a (1-x/2)mol
(3)Pb3O4 PbO 3:4