化学基础补习题14 姓名
1.
下图为固体物质A及其产物发生的一系列反应的框图,每一个方框内表示有一种反应物或生成物(反应条件及反应所需和生成的水均已略去),其中A、G为反应物,C、F在常温下均为气体:
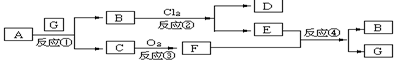
(1)试写出B和C的分子式:【答】:B为FeSO4 C为H2S
(2)写出把F通入到E物质的水溶液中所发生的反应④的离子方程式:【答】:SO2+2Fe3++2H2O == 2Fe2++SO42-+4H+
2.
举出下列含硫化合物实验现象的实例,写出相应的化学方程式。
(1)某气体的水溶液在空气中氧化后PH值升高。〖提示:硫化氢〗
(2)某物质的水溶液在空气中被氧化后PH值降低。〖提示:亚硫酸〗
(3)某钠盐的水溶液在空气中被氧化后,溶液质量减小。
【答:2NaHS+![]() =2NaOH+2S】
=2NaOH+2S】
(4)某钠盐的水溶液在空气中被氧化后,溶液质量增加。〖提示:亚硫酸钠〗
(5)某溶液不与空气中的氧气发生反应,但放置在空气中质量也会增加。
〖提示:![]() +x
+x![]() ®
®![]() 〗
〗
3.
将xmol尔H2S和1mol尔O2置于一个容积可变的容器内进行反应,维持容器内气体的压强不变(101千帕),在常温下测得反应前后容器内气体密度分别为d1和d2,若x的取值不同,则H2S的氧化产物可能有以下三种情况:(忽略气体的溶解)
(1)全部是SO2,此时的x的取值范围是
,且d1 d2(填大于、等于、小于)
(2)全部是S,此时x的取值范围是
(3)部分是S,部分是SO2,此时x的取值范围是
,容器内气体的物质的量为
mol(用含x的关系式表示)
【解】:该反应的化学方程式可表示如下:
xH2S+1O2 = ![]() SO2+
SO2+![]() S+xH2O
S+xH2O
(1)当氧化产物全部是SO2,此时![]() =0,由此可得当氧气不过量时x=
=0,由此可得当氧气不过量时x=![]() ,考虑到氧气可以 过量,所以x值的合理取值范围应是x£
,考虑到氧气可以 过量,所以x值的合理取值范围应是x£![]() ;同时可以发现,反应后生成的SO2的相对分子质量比H2S大,所以反应后气体密度增大,所以d1< d2
;同时可以发现,反应后生成的SO2的相对分子质量比H2S大,所以反应后气体密度增大,所以d1< d2
(2) 当氧化产物全部是S,此时, ![]() =0,x=2,考虑到要满足H2S过量这一条件,所以x³2
=0,x=2,考虑到要满足H2S过量这一条件,所以x³2
(3)x值介于(1)与(2)这间,也就是![]() <x<2
<x<2
4. 酸雨主要是燃烧含硫燃料时释放出SO2所造成的。现取一份雨水样品,每隔一定的时间测定其PH值,测定结果见附表
附表 雨水样品PH值随时间的变化值
| 测试时间(h) | 0 | 1 | 2 | 4 | 8 |
| 雨水样品PH值 | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
试说明雨水样品PH值减小的原因
〖提示〗:由上述数据可见,开始时样品的PH值随时间的推移而减小,一定时间后雨水样品的PH值不再发生变化。对于某一份在实验室里待测的雨水言,二氧化硫的继续溶解和挥发均可忽略不计,那么,其水溶液PH值的降低只能是它被空气中的氧气氧化成硫酸(强酸)所致:2SO2+2H2O+O2
== 2H2SO4。一定时间后,样品中的二氧化硫反应完全,PH值趋稳定。
5.
工业上产生的硫化氢要经处理成硫后方能排放,以防止大气污染。富玛克斯法治理硫化氢的方法和步聚如下:
(1)用2%~3%的Na2CO3溶液做吸收剂生成两种酸式盐
(2)再加入一种RNO(R表示芳香族有机物的基)与生成的一种酸式盐的水溶液反应生成硫、碱和R-NH-OH
(3)第(2)步生成的碱在溶液中与另一种酸式盐反应生成正盐
(4)R-NH-OH与空气中的氧发生反应又得到RNO
试写出以上四步反应的化学方程式
【答】:(1)Na2CO3+H2S
== NaHCO3+NaHS
(2)NaHS+RNO+H2O
== S+NaOH+R-NH-OH
(3)NaOH+NaHCO3 == Na2CO3+H2O
(4)2R-NH-OH+O2
== 2RNO+2H2O
6.
近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,第一步是用Na2SO3吸收SO2;第二步是加热吸收液,使之重新生成Na2SO3,
同时得到含高浓度SO2的水蒸汽副产品,试写出上述两步反应的化学方程式。
【答:Na2SO3+SO2+H2O
= 2NaHSO3、2NaHSO3 == Na2SO3+SO2+H2O】
7.
人体里的氧元素的质量占休重的65%,而氧原子的原子百分含量为25.5%;已知碳原子的百分含量为9.5%,则碳元素占体重的【答:18.16%】
〖提示〗:原子个数比=物质的量之比,所以,![]()
![]() ,也就有下列关系:
,也就有下列关系:
![]() 解得X=18.16
解得X=18.16
8.
现有0.5![]()
![]() 、1
、1![]()
![]() 、0.1
、0.1![]() KI、0.02
KI、0.02![]()
![]() 、1.0
、1.0![]() 盐酸、淀粉溶液,用离子方程式表明你证明
盐酸、淀粉溶液,用离子方程式表明你证明![]() 既有氧化性又有还原性的实验并说明现象。
既有氧化性又有还原性的实验并说明现象。
〖提示〗:证明其还原性:
5![]() +2
+2![]() +3
+3![]() =5
=5![]() +
+![]() +2
+2![]() +3
+3![]()
![]() 溶液的紫红色消褪。
溶液的紫红色消褪。
证明其有氧化性:
2![]() +2KI+4HCl=2NO+
+2KI+4HCl=2NO+![]() +2KCl+2NaCl+2
+2KCl+2NaCl+2![]() ,溶液变蓝。
,溶液变蓝。
9.
把29g铁和硫的混和物在密闭条件下加热反应,冷却至室温,再加入足量稀硫酸后,放出的气体在标准状况下为8.4升,则混和物中硫和铁的物质量之比为【答:硫:铁=3:2】
〖提示:产生的气体体积只与铁的量有关,而与硫的量无关〗
10. 将amolH2S和1molO2置于一个密闭容器中在120℃时反应,a的取值范围是【答:![]() 】;反应后生成SO2和H2O(气)的物质的量之和为【答:1+
】;反应后生成SO2和H2O(气)的物质的量之和为【答:1+![]() 】mol。
】mol。
〖提示〗:可采用直接配平法:
aH2S+O2=![]() SO2+
SO2+![]() S+aH2O
S+aH2O
可见n(SO2)+n(H2O)=![]() +a=1+
+a=1+![]()