化学计算专项训练二
【例题精选】:
例1:加热纯净的氯酸钾及二氧化锰的混合物15.5克,至反应完全停止后,冷却、称量,得试管中残留物10.7克。求:
①制得氧气多少克?
②10.7克残留物中含些物质?各多少克?
分析:
①这是实验室制取氧气常用的方法之一。
②必须正确书写该反应的化学方程式。
③明确二氧化锰是催化剂,反应前后其性质及质量均不发生变化——“不参加化学反应”。
④任何一个化学反应,都遵守质量守恒定律。
⑤试管中的残留物是二氧化锰及氯化钾的混合物。
⑥生成氧气的质量,应是反应前后固体物质的质量差:
15.5克-10.7克 = 4.8克
至少,题目可迎刃而解。
解:① 制得氧气:
(15.5-10.7)克 = 4.8克
② 设原混合物中氯酸钾的质量为x
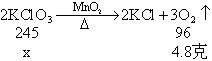
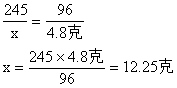
∴二氧化锰的质量为:
15.5克-12.25克 = 3.25克
氯化钾的质量为:
10.7克-3.25克 = 7.45克
或:
设反应后生成氯化钾的质量为y
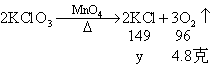
![]()
![]()
∴二氧化锰的质量为:
10.7克-7.45克 = 3.25克
答:略
例2:在12.4克硫酸钠及碳酸钠的混合物,加入适量的水溶解,在该混合溶液中加入稀硫酸后有气体放出,直到不再产生气体时为止,用去稀硫酸溶液49克,已知H2SO4的质量分数为10%;在反应后的溶液中继续加入足量的氯化钡溶液,有白色沉淀生成。求:
①加入稀硫酸后生成硫酸钠的质量;
②加入氯化钡溶液后,生成白色沉淀的质量。
分析:①经审题,应该明确这是一道有关化学方程式及溶液中溶质的质量分数的计算。
②应知道涉及到了两个化学反应:

③经对题目的分析,应该知道必须求出两个反应的生成物——Na2SO4;BaSO4的质量。
④经对题目分析,还应发现题目中的隐含条件——即第二个方程式中与BaCl2反应生成BaSO4的Na2SO4,应是原混合物中的Na2SO4与第一个化学方程式生成的Na2SO4两部分组成。因此在求BaCl2的质量时,要先计算出这两部分Na2SO4的质量;求和后再代入化学方程式中求解。
⑤容易出现的问题是——极易忽略了混合物中也含有Na2SO4。
解:设Na2CO3的质量为x,生成Na2SO4的质量为y,Ba2SO4的质量为z。

则:原混合物中Na2SO4的质量为:
12.4克-5.3克 = 7.1克
∴Na2SO4的总质量为:
7.1克 + 7.1克 = 14.2克

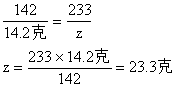
答:略
【专项训练】:
A组:
一、计算:
1、将4克氢氧化钠加入到50克盐酸溶液中恰好完全反应。求:
①盐酸溶液中溶质的质量分数;
②生成氯化钠的质量。
2、60℃时硝酸钾的溶解度为110克。60℃时将60.0克硝酸钾放入50.0克水中,充分溶解后,所得溶液中溶质的质量分数是多少?
3、硫酸铵样品中(NH4)2SO4的质量分数为95%,尿素样品中CO(NH2)2的质量分数为90%。求50千克硫酸铵样品中含氮元素的质量与多少千克的尿素样品中含氮元素的质量相等?
4、一碳酸钠溶液一质量是12克,当加入50克盐酸溶液后恰好完全反应。已知盐酸溶液中溶质的质量分数为14.6%,求反应后溶液中溶质的质量分数。
5、把100克80℃时的硝酸钾饱和溶液冷却到20℃,能析出硝酸钾晶体多少克?
6、把100克10℃时的硝酸钾饱和溶液升温到60℃,还能溶解硝酸钾晶体多少克?
(对5、6两题:硝酸钾的溶解度——10℃为21克;20℃为31.6克;60℃为108克;80℃为169克)
二、选择题:
每个小题只有一个选项符合题意,将正确选项的序号写在题后的括号内。
1、在五氧化二磷里磷元素与氧元素的质量比为( )
A.31∶40 B.62∶40 C.31∶80 D.31∶16
2、1.8克水与生石灰充分反应后,生成氢氧化钙的质量是( )
A.15.7克 B.9.1克 C.7.4克 D.56克
3、CuSO4·5H2O中,结晶水的质量分数是
A.63% B.36% C.48% D.84%
4、t℃时,某物质的饱和溶液中溶质的质量分数为30%,该物质在t℃时的溶解度为
( )
A.42.9克 B.30克 C.23.1克 D.75克
5、化学式为AxOy的氧化物,其相对分子质量为M,则A的相对原子质量是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
6、将300克质量分数为90%的硫酸稀释成质量分数为60%的硫酸,需要加水的质量为( )
A.200克 B.160克 C.150克 D.250克
7、已知反应:![]() 。当10克A物质与5克B物质恰好完全反应时,生成9克C物质。若需要生成3克D物质,则最少需要A物质的质量是( )
。当10克A物质与5克B物质恰好完全反应时,生成9克C物质。若需要生成3克D物质,则最少需要A物质的质量是( )
A.12克 B.8克 C.5克 D.6.3克
8、硫酸铜溶液与氢氧化钠溶液完全反应,两种溶液里含溶质的质量比为( )
A.1∶6 B.1∶2 C.2∶1 D.6∶1
9、9克某金属R与足量的稀盐酸反应,生成RCl3和1克氢气,那么金属R的相对原子质量为( )
A.18 B.9克 C.27 D.50克
10、实验室用8克高锰酸钾装入试管加热制取氧气,反应后称量得剩余固体物质2.2克。那么剩余物质是( )
A.KMnO4 B.KMnO4和K2MnO4
C.MnO2,KMnO4和K2MnO4 D.MnO2和KMnO4
11、下列算式计算正确的是( )
A.Na2CO3的相对分子质量 = 23×2+12+10(1×2+16)
B.CuSO4的相对分子质量 = 64 + 32 + 16 + 4
C.(NH4)SO4中N的质量分数![]()
D.CO(NH2)2中N的质量分数![]()
12、某物质在t℃时的溶解度为25克,t℃时该物质80克饱和溶液中含溶质的质量为
( )
A.20克 B.16克 C.30克 D.40克
13、下列化合物中N的质量分数最高的是( )
A.NH4HCO3 B.NH4NO3 C.CO(NH2)2 D.NH4Cl
14、某元素R与氢的化合物(RH4)中氢的质量分数为25%,则R的相对原子质量为
( )
A.28克 B.12克 C.28 D.12
15、某+2价的金属元素的氯化物,经测定知其Cl的质量分数为55.9%,则该金属元素可能是( )
A.钙 B.铜 C.锌 D.铁
16、使一氧化碳和氢气分别与足量的氧化铜在加热的条件下充分反应,如果要使生成的铜的质量一样多,那么消耗一氧化碳和氢气的质量比应该是( )
A.1∶1 B.14∶1 C.1∶14 D.2∶1
17、某氢氧化钠溶液溶质的质量分数为4%,吸收了11克二氧化碳恰好完全反应,那么所得碳酸钠溶液中溶质的质量分数为( )
A.4.85% B.32.6% C.5.19% D.18%
18、氯化钡溶液32.22克与20克硫酸溶液恰好完全反应,经过滤得到盐酸溶液50克,那么盐酸溶液中溶质的质量分数为( )
A.1.4% B.29.8% C.35.6% D.16.7%
【答案】:
一、计算题:
1、解:设与NaOH反应的HCl的质量为x,反应生成的NaCl的质量为y。

∴盐酸溶液中溶质的质量分数为:
![]()
答:略
2、解:设50.0克水中溶解KNO3的质量为x而达到饱和。
100∶110 = 50克∶x
![]() 克
克
则:所得溶液中溶质的质量分数为:
![]()
答:略
3、解:50千克硫酸铵样品中含(NH4)2SO4的质量为:
50千克×95% = 47.5千克
(NH4)2SO4中N元素的质量分数为:
![]()
则:硫酸铵样品中含氮元素的质量为:
47.5千克 ×21.2% = 10.1千克
含N元素的质量为10.1千克的CO(NH2)2的质量为:
![]()
∴含CO(NH2)2的质量为21.6千克的尿素样品的质量为:
21.6千克÷90% = 24.04千克
或:
设与50千克硫酸铵样品的中含N元素的质量相等的尿素样品的质量为x。

答:略
4、解:设反应生成的NaCl的质量为x,水的质量为y,参加反应的Na2CO3的质量为z。


则:Na2CO3溶液含水的质量:
12克-10.6克 = 1.4克
盐酸溶液含水的质量:
50克×(1-14.6%) = 42.7克
反应后NaCl溶液的质量:
1.4克 + 42.7克 +1.8克 + 11.7克 = 57.6克
∴氯化钠溶液中溶质的质量分数:
![]()
答:略
5、解:KNO3饱和溶液由80℃降温至20℃,析出KNO3晶体:
169克-31.6克 = 137.4克
设80℃100克KNO3饱和溶液降温至20℃可析出KNO3晶体质量为x,则
269∶137.4 = 100克∶x
![]() 或:
或:
直接计算:
![]() 已知饱和溶液∶x
已知饱和溶液∶x
说明:1)![]() 、
、![]() 分别KNO3在高温、低温的溶解度。
分别KNO3在高温、低温的溶解度。
2)x即表示降温后析出晶体的质量。
则:
(100 + 169)∶(169-31.6) = 100克∶x
![]()
答:略
6、解:先把10℃时100克KNO3饱和溶液中含KNO3的质量x
121∶21 = 100克∶x
![]() 克
克
则:
100克KNO3饱和溶液中溶剂质量为
100克-17.3克 = 82.7克
升温后82.7克溶剂中可溶解KNO3质量为y。
100∶108 = 82.7克∶y
![]() 克
克
∴还能溶解KNO3晶体:
89.3克-17.3克 = 72克
答:略
二、选择题:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | A | C | B | A | B | C | C | B | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | A | B | C | D | D | B | C | A |
B组:
1、10℃时,10.2克氯化铵饱和溶液和足量的硝酸银溶液完全反应,生成氯化银沉淀6.85克。求:①10℃时氯化铵的溶解度?
②10℃时氯化铵饱和溶液中氯化铵的质量分数?
2、已知Na2SO4样品中混有少量杂质NaCl,现取该样品7.5克溶于水,然后再逐滴加入BaCl2溶液到不再产生沉淀为止,过滤并干燥后,得沉淀物11.65克。若将滤液蒸干,可得到NaCl晶体多少克?
【答案】:
1、解:设参加反应的NH4Cl的质量为x。

10℃时NH4Cl的溶解度
![]()
10℃时,NH4Cl饱和溶液中NH4Cl的质量分数为:
![]()
答:略
2、解:设参加反应的Na2SO4的质量为x,生成NaCl的质量为y。

样品中含有NaCl的质量为:
7.5克-7.1克 = 0.4克
∴可得NaCl晶体的质量为:
(0.4 + 5.85)克 = 6.25克
答:略
【竞赛或趣味题】:
1、实验室用一氧化碳高温下还原赤铁矿石(主要成分为Fe2O3)样品3克,反应生成的二氧化碳与过量的石灰水起反应生成的白色沉淀质量为4克。求赤铁矿石里含Fe2O3的质量分数?(样品中的杂质不参加反应;反应生成的二氧化碳全部转化生成碳酸钙)
2、一氧化碳与二氧化碳混合气体质量为10克,混合气体中碳元素的质量分数为36%。将该混合气体通入足量的澄清的石灰水中,可生成沉淀多少克?
【竞赛或趣味题答案】:
1、分析:
1)该题一反常规,要由后往前做。
2)解题的关键是生成的4克沉淀。
3)要明确4克沉淀,是二氧化碳与足量澄清石灰水反应所得,因此计算生成二氧化碳的质量就成为解题所必须。
4)还要明确CO2是由CO和样品中Fe2O3反应而来,因此样品中纯Fe2O3的质量就可求了。
解:设与澄清石灰水反应生成4克沉淀的CO2的质量为x,样品中含Fe2O3的质量为y。

赤铁矿石中含Fe2O3的质量分数为:
![]()
答:略
2、分析:
1)要明确10克是CO与CO2两种气体的总质量。
2)C的质量分数——36%,是混合气体中CO中C元素的质量分数与CO2中C元素的质量分数之和。
3)关键在于求混合气体中CO2气体的质量。
4)明确下列关系:
CO——C CO2——C
28 12 44 12
5)要清楚CO中C元素的质量分数为![]() ;CO2中C元素的质量分数为
;CO2中C元素的质量分数为![]() 。
。
6)设混合气体中CO的质量为x,CO2的质量为y,列一个二元一次方程组,此题就可完成了。
解:设混和气体中CO的质量为x,CO2的质量为y,生成沉淀的质量为z。
据题意列方程组:
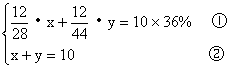
解这个方程组,得
x = 5.6 y = 4.4
即:原混合气体中CO质量为5.6克,CO2的质量为4.4克。
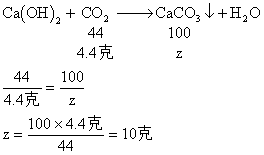
答:略