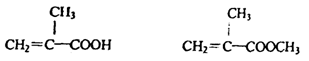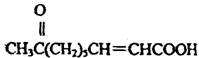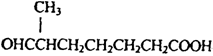高三年级化学学科下学期测试试题
化 学 试 题
(满分150分,完卷时间120分钟)
考生注意:
1.本试卷分卷和II卷。第I卷均为选择题,采用专题答题卡;第II卷采用答题纸。答题前,考生务必在答题卡和答题纸上清楚填写学校、姓名、准考证号码等,考试结束,答题卡和答题纸均交监考老师。
2.第I卷(1—22小题),由机器阅卷,答案必须全部涂写在答题卡上。考生应将代表正确答案的小方格用铅笔涂黑,注意试题题号和答题纸编号一一对应,不能错位。答案需要更改时,必须将原选项用橡皮擦去,重新选择。答案不能写在试卷上,写在试卷上一律不给分。
3.第II卷第23题和第26题为分叉题,备分为A、B两题,考生可任选一题。若两题均做,一律按A题计分。A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
相对原子质量:H 1 C 12 N 14 O 16 S 32 Na 23 Mg 24 Al 27 K 39 Ca 40
Mn 55 Fe 56 Cu 64 Zn 65
第Ⅰ卷(共66分)
一、选择题(本题共10分):每小题2分,只有一个正确选项,答案涂写在答题卡上。
1.科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是 ( )
A.该粒子不显电性 B.该粒子质量数为4
C.该粒子核电荷数为0 D.该粒子在周期表中与氢位于同一个位置
2.意大利科学家最近合成了一种新型氧分子,它由4个氧原子构成,专家认为它激化后的能量和密度普通氧分子高得多,下列关于该分子叙述正确的是 ( )
A.它的摩尔质量是64 B.它是氧元素的另一种同素异形体
C.它是氧元素的另一种同位素 D.它将成为一种新型的强力火箭推进燃料
3.下列说法正确的是 ( )
A.甲醛可以做食品防腐剂
B.pH在5.6~7.0之间的降水通常称为酸雨
C.燃煤时加入适量石灰石,可减少废气中SO2的量
D.臭氧的体积分数超过10—4%的空气有利于人体健康
4.下列叙述正确的是 ( )
A.聚丙烯的结构简式为 [ CH2—CH—CH3 ]n
B.石英的化学式为:CaSiO3
|
D.Ar原子的结构示意图为
5.下列四项高新技术都会随着科学技术的发展而取得突破性的改进,大大地改变二十一世纪的人类生活。其中,将对改变人们的传统化学科学观念产生影响最大的可能是( )
A.纳米技术 B.基因技术 C.太阳能技术 D.电脑技术
二、选择题(本题共36分):每小题3分,只有一个正确选项,答案涂写在答题卡上。
6.用食用白醋(醋酸浓度约1mol·L—1)进行下列实验,能证明醋酸为弱电解质的是( )
A.白醋中滴入石蕊试液呈红色 B.白醋加入豆浆中有沉淀产生
C.蛋壳浸泡在白醋中有气体放出 D.pH试纸显示白醋的pH为2~3
7.下列各组混合物的分离和提纯方法不正确的是 ( )
A.用蒸馏法分离乙醇和苯酚的混合物
|
C.用结晶法提纯NaCl和KNO3混合物中的KNO3
D.用渗板法分离Fe(OH)3胶体和FeCl3溶液的混合物
8.如右图所示,集气瓶内充满某混合气体,置于光亮处,
将滴管内的水挤入集气瓶后,烧杯中的水会进入集气
瓶,则集气瓶中气体是 ( )
①CO、O2 ②Cl2、CH4
③NO2、O2 ④N2、H2
A.①② B.②④ C.③④ D.②③
9.为达到预期的实验目的,下列操作正确的是 ( )
A.欲配制质量分数为10%的ZnSO4溶液,将10gZnSO4·7H2O溶解有90g水中
B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C.为鉴别KCl、AlCL3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
|
A.饱和食盐水 B.0.1mol·L—1的盐酸
C.0.1mol·L—1的CaCl2溶液 D.新制的饱和氯水
11.判断下列有关化学基本概念的依据正确的是 ( )
A.金属晶体:晶体是否能够导电
B.共价化合物:是否含有共价键
C.强弱电解质:溶液的导电能力大小
D.氧化还原反应:元素化合价是否变化
12.用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是 ( )
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊。再升高至65℃以上,溶液变澄清。 | C6H5ONa溶液 |
| B | 通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊。再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
13.有①Na2CO3溶液,②CH3COONa溶液,③NaOH溶液各25mL,物质的量浓度均为
0.1mol·L—1,下列说法正确的是 ( )
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL0.1mol·L—1盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
14.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气
|
①CH3OH(g)+H2O(g)→CO2(g)+3H2(g)—49.0kJ
②CH3OH(g)+1/2O2(g)→CO2(g)+2H2(g)+192.9kJ
下列说法正确的是 ( )
A.1molCH3OH完全燃烧放热192.9kJ
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:
CH3OH(l)+1/2O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ
15.下列关于晶体的说法正确的是 ( )
A.晶体中只要有阳离子变一定有阴离子
|
C.原子晶体的熔点一定比金属晶体的高
D.构成分子晶体的微粒一定含有共价键
16.如右图所示,下列叙述正确的是( )
A.Y为阴极,发生氧化反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处变红
D.X与滤纸接触处有氢气生成
17.下列离子方程式书写正确的是 ( )
A.过量的SO2通入NaOH溶液中:SO2+2OH—→SO2—3+H2O
B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I—→2Fe2++I2
C.NaNO2溶液中加入酸性KMnO4溶液:2MnO—4+5NO2—+6H+→2Mn2++5NO—3+3H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:
2HCO—3+Ba2++2OH—→BaCO3↓+2H2O+CO2—3
|
18.右图是一套实验室制气装置,用于发生、干燥、
收集和吸收有毒气体。下列各组物质能利用这
套装置进行实验的是 ( )
A.电石和水
B.MnO2和浓盐酸
C.Cu片和浓硝酸
D.Na2SO3(s)和浓硫酸
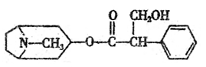
|
说法正确的是 ( )
A.金丝桃素的分子式煤C17H23O5N
B.1mol金丝桃素最多能与4molH2发生加成反应
C.金丝桃素能与浓硫酸和浓硝酸的混合液反应
D.金丝桃素在NaOH溶液中加热反应得到的两种芳香族化合物
20.下列叙述正确的是 ( )
A.48gO3气体含有1.81×1024个原子
B.常温常压下,含有6.02×1022个NO2分子的气体质量为4.6g
C.常温下,1L0.5mol·L—1CuCl2溶液中含有3.01×1023个Cu2+
D.标准状况下,33.6LH2O含有9.03×1023个H2O分子
|
| 甲 | 乙 | 丙 | 结论 | |
| A | 水 | 电石 | 溴水 | 稳定性:水>C2H2>Br |
| B | 盐酸 | 石灰石 | 苯酚钠溶液 | 酸性:HCl>H2CO3>苯酸 |
| C | 盐酸 | FeS | 溴水 | 还原性:S2—>Br—>Cl— |
| D | 浓盐酸 | KMnO4 | KBr溶液 | 氧化性:KMnO4>Cl2>Br2 |
22.有6g含杂质的Na2SO3与足量的盐酸反应,得气体1.12L(标准状况),且该气体的平均相对分子质量为60,则此杂质可能是 ( )
A.Na2CO3 B.NaHCO3
C.Na2CO3和NaHCO3 D.Na2SO4
第Ⅱ卷(共84分)
|
四、(本题共24分)
考生注意:23题为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题计分。A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
23.(A)A、B、C、D、E、F是原子序数依次增大的六种常见元素。E的单质在C2中燃烧的产物可使品红溶液褪色:F和C元素形成的化合物F3C4具有磁性;A的单质在C2中燃烧可生成AC和AC2两种气体;D的单质是一种金属,该金属在AC2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)F元素在周期中的位置是 。
(2)AC2的结构式为 ;DC的电子式为 。
(3)元素C与元素E相比,非金属性较强的是 (用元素符号表示)能证明这一事实的是 。
(4)A、B、C形成的10电子氢化物中,A、B的氢化物沸点较低的是(写化学式)
;B、C的氢化物分子结合H+能力较强的是(写化学式)
,用离子方程式加以说明 。
23.(B)A、B、C、D、E、F是原子序数依次增大的六种常见元素。E的单质在C2中燃烧的产物可使品红溶液褪色:F和C元素形成的化合物F3C4具有磁性;A的单质在C2中燃烧可生成AC和AC2两种气体;D的单质是一种金属,该金属在AC2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)F元素在周期中的位置是 。
(2)AC2的结构式为 ;DC的电子式为 。
(3)元素C与元素E相比,非金属性较强的是 (用元素符号表示)能证明这一事实的是 。
(4)EC2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体BC,有关反应的离子方程式为 ,由此可知BC和EC2还原性较强的是(写化学式)
。
![]() 24.NaNO2大量用于染料工业和有机合成工业中。然而由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须经处理后才能排放。处理方法如下:
24.NaNO2大量用于染料工业和有机合成工业中。然而由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须经处理后才能排放。处理方法如下:
![]() NaNO2+ KI+ → NO+
I2+
K2SO4+ NaSO4+
NaNO2+ KI+ → NO+
I2+
K2SO4+ NaSO4+
(1)请完成该化学方程式,配平并标出电子转移的方向和数目。
(2)在上述反应中,若要生成15gNO,则电子转移了 个。
(3)在上述反应中,硫酸体现了 性质。
(4)用上述反应来处理NaNO2并不是最佳方法,其原因是生成了 ,该物质会造成 。从环保角度讲,要处理NaNO2所用的物质的 (填“氧化性”或“还原性”)应该比KI更 (填“强”或“弱”)
25.氮气和氢气在一定条件下在一密闭容器中发生如下反应:
|
(1)写出该反应的化学平衡常数表达式
。
(2)降低温度,该反应的K值 ,
化学反应速率 ,氨气的百
分含量 (以上均填“增大”、
“减小”或“不变”)。
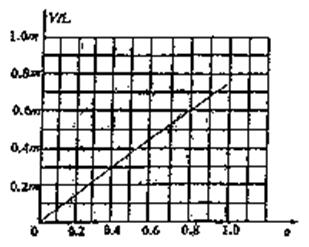
(3)上图表示上述反应在某一时间段中反应
速率与反应过程的关系图。据图判断氨
的百分含量最高的一段时间是 。
(4)据图判断反应在t2~t3这段时间内,曲线变化的原因是 (用文字表达),
t5~t6时间内曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.扩大容器的体积 c.降低温度 d.增加了NH3的量
(5)丙同学改用图3装置,通过测定烧杯中NaOH溶液的增重来确定样品中NaHCO3的含量。你认为乙、丙两同学的方案中更合理的是 ,理由是
。
五、(本题共24分)
考生注意:26题为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题计分。A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
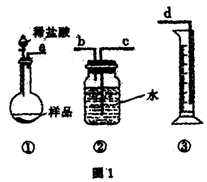
26.(A)某学生实验兴趣小组拟用图1装置来完成“NaHCO3和NaCl混合物中NaHCO3含量的测定”的实验。
(1)各仪器接口连接顺序是 (用接口字母填写)。
|
。
(3)甲同学认为上述方法误差较大,提出如下改进
措施,你认为可行的有 (填序号)。
A.将装置①中稀盐酸换成稀硫酸,装置②中
水面上滴加少量植物油
B.将装置①中稀盐酸换成稀硫酸,装置②中
水换成饱和NaHCO3溶液
C.将装置①中稀盐酸换成稀硫酸,装置②中
水换成饱和Na2CO3溶液
|
积存水,使测定结果不准,从而改用图
2装置。假定滴定管起始读数为V1mL,
终了读数为V2mL,而注射器测定排出
的气体为V3mL(标准状况下),
混合物样品质量为m g,则原混合物中
NaHCO3的质量分数的表达式为
(用含V1、V2、V3、m的式子表示)。
|
试回答:
(1)A装置可用来观察二氧化硫和氧气的进气量。实验时应使A中两根导气管冒出气泡的速率相等,其目的是 ,
A中的药品是 。
(2)检查完装置的气密性且加入药品后,开始进行实验。此时首先应该进行的操作是
。
(3)在实验过程中不能持续加热的理由是 。
(4)C装置用来收集三氧化硫,其中冰盐水的作用是 ;若用ag铜跟足量浓硫酸反应制二氧化硫,实验结束时得到bg三氧化硫,则该实验中二氧化硫的转化率不小于 。
(5)为了减轻实验对环境的污染,请你设计尾气处理装置(用简要文字说明):
。
|
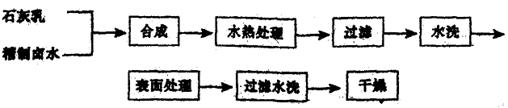
(1)精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2—nCln·mH2O],反应的化学方程式为 。
(2)合成反应后,继续在393K~523K下水热处理8h,发生反应:
Mg(OH)2—nCl·mH2O→![]() Mg(OH)2+
Mg(OH)2+![]() MgCl2+mH2O
MgCl2+mH2O
水热处理后,过滤、水洗。
①检验滤液中含有Cl—的方法是 。
②水洗的目的是 。
(3)阻燃剂Mg(OH)2具有晶粒大、易分散、与高分子材料相溶性好等特点。上述工艺流程中与此有关的步骤是 。
(4)已知热化学方程式:Mg(OH)2(s)→MgO(s)+H2O(g)—81.5kJ
Al(OH)2(s)→![]() Al2O3(s)+
Al2O3(s)+![]() H2O(g)—87.7kJ
H2O(g)—87.7kJ
①Mg(OH)2和Al(OH)2都能起阻燃作用,其主要原因是 。
②等质量Mg(OH)2和Al(OH)2相比,阻燃效果较好的是 ,
原因是 。
(5)常用阻燃剂主要有三类:卤系,如四溴乙烷;磷系,如磷酸三苯酯;无机类,主要是Mg(OH)2和Al(OH)2。从环保的角度考虑,应用时较理想的阻燃剂是 类,
原因是 。
六、(本题共20分)
|
|
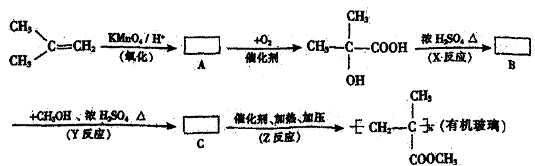
请回答下列问题:
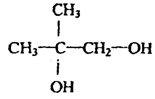
(1)写出结构简式:
A: ;B: ;C: 。
(2)写出反应类型:
X反应 ;Y反应 ;Z反应 。
29.蜂皇酸是峰王浆的主要活性成分之一,具有灭菌、防辐射、防脱发、抗癌等多种生理功能,蜂皇酸的含量是评价蜂王浆质量的重要指标。蜂皇酸Q中含碳、氢、氧三种元素,其中碳的质量分数为65.2%,氢的质量分数为8.7%;Q具有酸性,1molQ需要1molNaOH完全中和;1molQ可以和1molBr2加成,经测定Q的相对原子质量不大于200。各有机物的转化关系如下图所示:
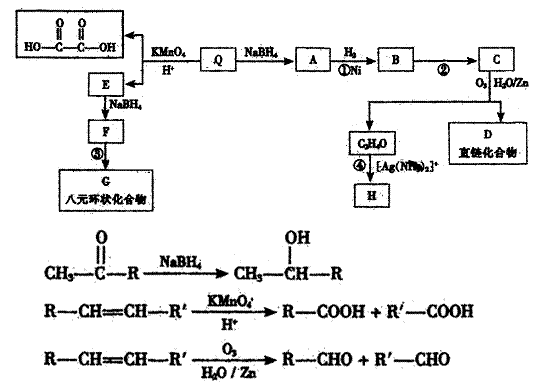 |
已知
请回答下列问题:
(1)写出Q的分子式 ;Q的结构简式 ;Q在转化过程中能发生氧化反应的官能团为 。
(2)写出反应类型:反应① ;反应④ 。
(3)写出反应条件:反应② ;反应③ 。
(4)写出和D含有相同官能团的同分异构体的结构简式 (任意写一种)
(5)写出和E互为同系物的物质的结构简式 (任意写一种)。
(6)写出F→G的化学方程式: 。
七、(本题共16分)
30.化合物KzFe(C2O4)y·zH2O是一种重要的光化学试剂,其中铁为+3价。分别称取该样品0.491g两份,其中一份在110℃干燥脱水,至质量恒定为0.437g。另一份置于锥形瓶中,加入足量的3mol·L—1H2SO4和适量的蒸馏水,加热至75℃,趁热加入0.0500mol·L—1KMnO4溶液24.0mL,恰好完全反应;再向溶液中加入适量的某种还原剂,将Fe3+完全转化为Fe2+,该溶液中Fe2+刚好与4.0mL0.0500mol·L—1KMnO4溶液完全反应。
已知:2KMnO4+5H2C2O4+3H2SO4→2MnSO4+K2SO4+10CO2↑+8H2O
MnO—4+5Fe2++8H+→Mn2++5Fe3++4H2O
通过计算,分别求:
(1)0.491g样品中结晶水的物质的量。
(2)化合物的化学式。
31.自然界存在着一种白云石的矿石,其化学式是xCaCO3·yMgCO3。以它为原料,可制取耐火材料等。
(1)称取27.6g白云石,加热到质量不再变化,可以生成耐火材料MgO多少mol?(用x、y的代数式表示)
(2)若在上述反应中,收集到CO26.72L(标准状况下),试写出白云石的化学式(取x、y的最小正整数比)。
(3)若把收集到的6.72LCO2用NaOH来吸收,将CO2通入200mL2.25mol·L—1NaOH溶液中,充分反应后,试确定溶液中CO2—3和HCO—3的物质的量之比(不考虑离子的水解)。
(4)若称取白云石mg,研碎后与过量炭粉混合,放在特定仪器中隔绝空气强热一段时间后,测得白云石分解率为a,生成VL(标准状况)一氧化碳。试计算V为多少L(标准状况)?(用m、a代数式表示)
(已知CaO+3C CaC2+CO;2MgO+5C Mg2C3+2CO)
|
参考答案
一、选择题(本题共10分)
1.D 2.B 3.C 4.C 5.A
|
6.D 7.B 8.D 9.C 10.A 11.D 12.B 13.C 14.D
15.B 16.C 17.C
三、选择题(本题共20分)
18.CD 19.AC 20.A 21.BD 22.C
四、(本题共24分)
|
(A)(1)第四周期第VIII族 (2)O=C=O
(3)O 氧的氢化物比硫的氢化物稳定 (合理即给分)
|
(B)(1)第四周期第VIII族 (2)O=C=O
(3)O 氧的氢化物比硫的氢化物稳定 (合理即给分)
(4)3SO2+2NO—3+3Ba2++2H2O→3BaSO4↓+2NO+4H+ (2分) SO2
24.(每格1分,共9分)
(1)2NaNO2+2KI+2H2SO4→2NO+I2+K2SO4+Na2SO4+2H2O (3分)
(2)3.01×1023 (3)酸性
(4)NO 大气污染(或酸雨问题) 还原性 强
25.(每格1分,共7分)
(1)K=c2(NH3)/c(N2)c3(H2) (2)增大 减小 增大
(3)t1~t2 (4)升高温度 b
五、(本题共24分)
26.(每格2分,共12分)
(A)(1)a、b、c、d
(2)在②中加水浸没长导管,关闭分液漏斗活塞,用手握住圆底烧瓶,若②中长导管内液面上升,则说明气密性良好。
(3)A、B
(4)84(V3+V1—V2)/22400m×100%
(5)乙同学 丙同学的方案中生成CO2不会全部被NaOH溶液吸收
(B)(1)提高SO2的转化率(1分) 浓硫酸(1分)
(2)给催化剂加热
(3)该反应为放热反应,防止温度过度降低SO2的转化率
(4)降温使SO3疑结成晶体 4b/5a×100%
(5)将尾气通入盛有浓H2SO4的洗气瓶后再通入盛有NaOH溶液的洗气瓶
27.(每格1分,共12分)
(1)2MgCl2+(2—n)Ca(OH)2+2mH2O→2[Mg(OH)2—nCln·mH2O]+(2—n)CaCl2 (2分)
(2)①取样滤液,滴加硝酸酸化的AgNO3溶液,有白色沉淀。
②除去附着在Mg(OH)2表面的可溶性物质MgCl2、CaCl2等。
(3)表面处理
(4)①Mg(OH)2和Al(OH)2受热分解时吸收大量的热使环境温度下降;同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,阻燃效果更佳。(2分)
②Mg(OH)2 等质量的Mg(OH)2比Al(OH)2吸热多
(5)无机类 卤系和磷系沸点低,高温时有烟生成,且高温时受热分解产生有毒、有害的污染物,无机类高温时无烟、无毒、腐蚀性小。 (2分)
六、(本题共20分)
|
|
(1)
|
29.(每格1分,共14分)
(1)C10H16O3
(2)加成反应 氧化反应
|
(4) (2分)(合理即给分)
|
|
(6)
(2分)
七、(本题共16分)
30.(共6分)
(1)(2分)n(H2O)=0.00300mol
(2)(4分)n(C2O2—4)=0.00300mol n(Fe3+)=n(Fe2+)=0.00100mol
1: y : z = 0.00100 : 0.00300 : 0.00300 y =3,z=3
x+3=2y,x=3
所以,化合物的化学式为:K3Fe(C2O4)3·3H2O
31.(共10分)
(1)(2分)n(MgO)=27.6y/ (100x+84y)
(2)(2分)CaCO3·MgCO3
(3)(2分)1:1
(4)(4分)∵CaO~CO MgO~CO CO2~2CO
∴CaCO3·MgCO3~6CO
|