高中化学样本分析考试试卷
考生注意:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共120分。考试用时100分钟。
2.本试卷主要考试内容:高中化学必考部分(必修1、必修2、选修4、选修5)+选考部分(选修3、选修6)
3.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Pb-207
第Ⅰ卷(选择题 共48分)
一、单选题(本题包括8小题,每小题3分,共24分。每题只有一个选项符合题意)
1.下列关于某些社会热点问题的说法中,错误的是
A.光化学烟雾的产生与大量排放碳氢化合物、氮氧化合物有关
B.臭氧空洞的形成与氟氯烃或氮氧化合物泄漏到大气中有关
C.甲醛是某些劣质装饰材料释放的常见污染物之一
D.禁止使用含铅汽油是为了提高汽油燃烧效率
2.在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物。下列说法正确的是
A.34S原子核内中子数为16 B.在相同条件下1H216O比1H218O更易挥发
C.13C和15N原子核内的质子数相差2 D.2H+的酸性比1H+的酸性更强
3.磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将等物质的量FeSO4和Fe2(SO4)3溶液混合,滴入稍过量的氢氧化钠溶液,随后加人油酸钠溶液,即可生成黑色的分散质粒子直径在5.5~36nm磁体流体。下列说法中正确的是
A.所得的分散系属于溶液
B.所得的分散系中分散质为Fe2O3
C.当一束强可见光通过该分散系时会出现光亮的通路
D.该分散系很不稳定
4.实验是化学研究的基础,关于下列各实验装置的叙述中,正确的是
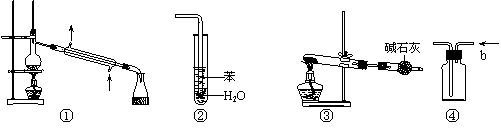 |
A.装置①常用于分离互不相溶液体混合物
B.装置②可用于吸收HCl气体,并防止倒吸
C.以NH4HCO3为原料,装置③可用于实验室制备少量NH3
D.装置④b口进气可收集CO2、NO等气体
5.随着科学技术的发展,化学研究的手段日趋先进,下列对技术在化学研究中的应用的说法中不正确的是
A.仅用红外光谱图即可确定复杂有机物的分子结构
B.用pH计测定溶液的pH
C.用质谱仪测定有机物的相对分子质量
D.用同位素示踪法研究有机反应的机理
6.下列化学反应在冶金工业中没有得到广泛应用的是
A.MgCl2(熔融) ![]() Mg+Cl2↑
B.Al2O3+3C
Mg+Cl2↑
B.Al2O3+3C ![]() 2Al+3CO↑
2Al+3CO↑
C.Fe2O3+3CO![]() 2Fe+3CO2↑ D.2Ag2O
2Fe+3CO2↑ D.2Ag2O![]() 4Ag+O2↑
4Ag+O2↑
7.下列各组离子可能大量共存的是
A.不能使酚酞试液变红的无色溶液中:Na+、CO![]() 、K+、ClO-、AlO
、K+、ClO-、AlO![]()
B.能与金属铝反应放出氢气的溶液中: K+、NO![]() 、Cl-、NH
、Cl-、NH![]()
C.常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO![]()
D.含有HCO![]() 的溶液中:K+、OH-、NO
的溶液中:K+、OH-、NO![]() 、Ca2+
、Ca2+
8.R、M、T、G、J为原子序数依次递增的同一短周期主族元素,下列说法一定正确的是(m、n均为正整数)
A.若R、M的最高价氧化物的水化物均为碱,则R(OH)n的碱性一定比M(OH)n+1的碱性强
B.HnJOm为强酸,则G是位于VA族以后的活泼非金属元素
C.若T的最低化合价为-3,则J的最高正化合价为+6
D.若M的最高正化合价为+4,则五种元素都是非金属元素
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9.下列离子方程式书写正确的是
A.用碳酸钠稀溶液吸收少量二氧化碳:CO![]() +CO2+H2O=2 HCO
+CO2+H2O=2 HCO![]()
B.向小苏打溶液中加入醋酸:CO![]() +2CH3COOH=CO2↑+H2O+2CH3COO-
+2CH3COOH=CO2↑+H2O+2CH3COO-
C.向硫酸氢钠溶液中加入少量氢氧化钠:H++OH-=H2O
D.向FeBr2溶液中加入过量的氯水:2Fe2++2Br-+2Cl2=Br2+4Cl-+2Fe3+
10.若NA阿伏加德罗常数,下列有关说法中正确的是
A.通常状况下,1mol NaHCO3投入足量盐酸中,完全反应后,最多逸出NA个CO2分子
B.NO2和N2O4混合气体 46 g ,其中含有的原子数为3NA
C.若某醋酸钠溶液中含有1mol CH3COO-,则Na+数目等于NA
D.O3和O2的混合气体22.4L中一定含有3NA个原子
 11.右图表示的是一种金属醇盐的dianhauxue合成装置。在电解过程中,已知乙醇和乙酰并(CH3COCH2COCH3)在阴极发生的电极反应为:
11.右图表示的是一种金属醇盐的dianhauxue合成装置。在电解过程中,已知乙醇和乙酰并(CH3COCH2COCH3)在阴极发生的电极反应为:
2CH3CH2OH+2e-=2CH3CH2O-+H2↑
![]()
下列说法中正确的是
A.阳极Pb失去电子,发生还原反应
B.当阳极失去2mole-时,阴极产生2mol氢气
C.电解过程中,阳离子向阴极移动
D.已知Pb-4e-=Pb4+,当消耗Pb的质量为103.5g时,则转移电子2mol
12.下列有关化学反应方向的描述中不正确的是
A.一定条件下的可逆反应,反应物的转化率不可能达到100%
B.在自发进行的氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性
C.沉淀的转换的实质就是沉淀溶解平衡的移动,平衡一般向生成更难溶物质的方向移动
D.自发进行的化学反应,一定是△H<0,△S>0的反应
13.茶多酚是一类目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂的总称。其中没食子儿茶素(EGC)的结构如右图所示。关于EGC的下列叙述中正确的是
A.EGC是一种芳香烃
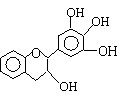 B.1molEGC与4molNaOH恰好完全反应
B.1molEGC与4molNaOH恰好完全反应
C.遇FeCl3溶液能不发生显色反应
D.易发生氧化反应和取代反应,相对较难发生加成反应
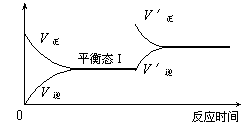 |
14.如图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不相符合的是
A.反应达平衡时,正反应速率和逆反应速率相等
B.若反应为A(g)+B(g)![]() C(s),则平衡移动的原因是增大压强
C(s),则平衡移动的原因是增大压强
C.由图像关系可以判断,正反应为吸热反应
D.由平衡状态Ⅰ和平衡状态Ⅱ的平衡常数的大小关系为K1=K2
第Ⅱ(非选择题,共72分)
三、(本题包括2小题,共12分)
15.(4分)下列实验操作或对实验事实的描述中不正确的是______________。
①燃着的酒精灯不慎碰翻失火,可立即用湿布盖灭
②滴定用的锥形瓶和滴定管都要用所盛溶液润洗
③分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
④配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
⑤不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
⑥用托盘天平称量时,所称药品均可放在纸上,并置于天平的左盘
⑦测定溶液的pH时,可用洁净、干燥的玻璃棒蘸取溶液,滴在pH试纸上,再与标准比色卡比较
⑧浓硝酸与浓盐酸均易挥发,故均应保存在棕色试剂瓶中,并置于阴凉处
⑨配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液的浓度偏高
⑩可以用酸式滴定管量取20.00mL0.1000mol·L-1KMnO4溶液
16.(8分)士兵在野外加热食物时通常采用“无焰食物加热器”,其主要化学成分为镁粉、铁粉、氯化钠,使用时加入水与其中的镁反应放出热量。下面是在形同的室温下对该产品的两个探究实验:
【实验1】向加有等量水的隔热容器中分别加入下列各组物质,结果参见下图1。
①1.0mol镁条、0.10mol铁粉、0.10mil氯化钠粉末;
②将1.0mol镁条剪成100份、0.10mol铁粉、0.10mil氯化钠粉末;
③1.0mol镁粉、0.10mol铁粉、0.10mil氯化钠粉末;
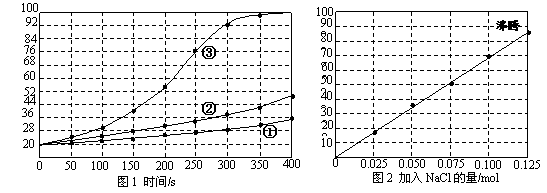 |
【实验2】向加有100mL水的隔热容器中分别加入0.10mol镁粉、0.50mol铁粉及不同量的氯化钠粉末,不断搅拌,第15min时记录温度升高的幅度参见上图2。
请回答下列问题:
⑴实验1证实影响镁与水反应速率的主要因素是_________________。
A.反应温度 B.NaCl的用量 C.铁的用量 D.镁的表面积
⑵实验2中当NaCl的用量大于0.125mol时,实验就无须再做的原因是__________。
A.加入更多的NaCl不再增加反应速率 B.加入NaCl反而会降低反应速率
C.已达到沸点不再有温度变化 D.需要加入更多的铁粉来提高温度
⑶如果在实验2中加入了0.060molNaCl,则第15min时混合物的温度最接近于______。
A.34℃ B.42℃ C.50℃ D.62℃
⑷铁粉、NaCl能使反应速率增加的原因是______________________________________。
四、本题包括2小题,共18分。
17.(8分)右图是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源正极。
 ⑴As(砷)位于元素周期表中第四周期VA族,则Na3AsO4溶液的pH__________(填“>7”“<7”“=7”)。
⑴As(砷)位于元素周期表中第四周期VA族,则Na3AsO4溶液的pH__________(填“>7”“<7”“=7”)。
⑵向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是____________________________,D电极上的电极反应式为______________。
⑶一段时间后,再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移。
此时整套实验装置的总的离子方程式为_____________________。
⑷再过一段时间后,G的指针逐渐归零,此时实验装置中的化学反应已经达到化学平衡状态,该反应的化学平衡常数的表达式为:K=_______________________________。
 |
18.(10分)下图涉及多种无机化工反应,其中R是一种新型无机材料,M是一种应用广泛的金属材料,F是人工合成的第一种有机物,且是一种常见的化学肥料,A、C、D、M均为常见元素的单质,“↑”表示该物质常温下是气体,反应G+J→F+H2O中G与J的最佳配比为2∶1,向Y溶液中通入足量的J气体时可得到一种白色胶状沉淀,将该白色胶状沉淀滤出洗净后加热分解可以得到B。
⑴试写出下列指定物质的化学式:B_________________,F_____________。
⑵反应①的化学方程式为___________________________________________。
⑶反应④的离子方程式为___________________________________________。
⑷上述反应中属于非氧化还原反应的有_____________(填写相应反应的序号)。
五、本题包括1小题,共12分。
19.(12分)多巴胺是一种重要的中枢神经传到物质,其分子结构如右图所示。试回答下列问题:
Ⅰ.多巴胺分子中最多有______个碳原子共某一平面;在多巴胺分子的核磁共振氢谱中可以发现有_______个特征吸收峰。
Ⅱ.从多巴胺的分子结构推测,多巴胺应该_______(填“能”或“难”)溶于水,其原因是__________________________________________;多巴胺属___________(填“酸性”、“碱性”或“两性”)有机物,其原因是______________________________________。
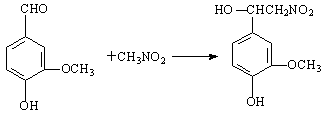
Ⅲ.多巴胺可由香兰素与硝基甲烷反应后再经锌汞齐还原水解制得。合成过程可如下表示:

⑴M的分子式为__________________。
⑵合成多巴胺途径中属于取代反应的是_________(填编号),反应④属于_______(填反应类型)反应。
⑶写出反应①的化学方程式:____________________________________________。
六、本题包括1小题,共8分。
20.(8分)合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。其制备及运用的一种工艺流程如图所示(其中X与X′的主要成分类似)。
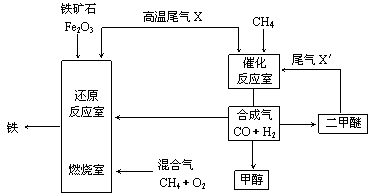 |
⑴在合成气冶炼金属铁的流程中,向燃烧室中通入甲烷与氧气的目的是_____________,其最佳体积配比V(CH4)∶V(O2)为__________。
⑵甲醇、二甲醚(CH3OCH3)等物质被称为21世纪的新型燃料,具有清洁、高效等优良的性能。
①写出用合成气生产甲醇的化学方程式:__________________________,用该方法合成甲醇的最大优点是______________________________________________。
②用合成气为原料生产二甲醚,随着原料配比的不同反应产物不尽相同,但产生的尾气可循环使用,试写出以CO、H2为原料制取二甲醚的两种不同的化学方程式:_____
_______________________________、___________________________________。
⑶某化工厂试图使用上图所示流程联合生产甲醇、二甲醚、生铁,你认为是否可行?若不可行,请说明理由;若可行,联合生产有什么优点?___________________________
_____________________________________________________________________。
七、本题包括1小题,共10分。
21.(10分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
⑴实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:____________________________________。
⑵由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2+3H2![]() 2NH3 △H=a kJ·mol-1。试根据表中所列键能数据估算a 的数值:_______________。
2NH3 △H=a kJ·mol-1。试根据表中所列键能数据估算a 的数值:_______________。
⑶依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:________________________________。
八、选做题(本题分A、B两题,考生只要选择其中1题作答。若两题都作答,则以A题得分计入总分。本题共12分。)
22.A.(12分)(物质结构与性质)
⑴原子数目和电子总数(或价电子总数)相同的微粒互称等电子体,等电子体具有相似的结构特征。试写出短周期元素形成的含有14个电子的分子的化学式:_____________,其中_____和_____互为等电子体,CO分子的电子式为______________。
⑵CH3CHO分子中,-CH3中的碳原子采用________杂化方式,-CHO中的碳原子采取______杂化方式。
 ⑶2007年诺贝尔化学奖获得者Gerhard Ertl利用光电子能谱证实:洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比值的最大值为________________。
⑶2007年诺贝尔化学奖获得者Gerhard Ertl利用光电子能谱证实:洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比值的最大值为________________。
B.(12分)(实验化学)
硫酸铜是一种应用极其广泛的化工原料。铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)。
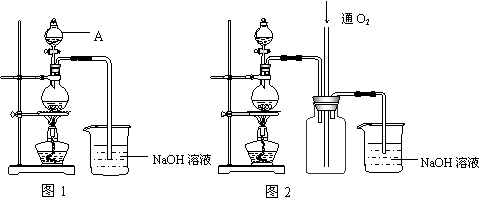 |
⑴图1烧瓶中发生的离子反应方程式为: 。
⑵图2是图1的改进装置,其优点有:
① ;
② 。
⑶为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加FeSO4或Fe2(SO4)3,即发生反应。反应完全后向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,滤渣作催化剂循环使用。(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4。)
请回答下列问题:
①方案1中的B仪器名称是 。
②方案2中甲物质是 (填字母序号)。
a、CaO b、CuCO3 c、CaCO3
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h后,升温到60℃,持续反应1 h后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.6g。
请回答下列问题:
③加热时温度不宜过高的原因是 ,晶体采用酒精淋洗的优点是 。
④上述两种氧化法中,更符合绿色化学理念的是 (填“第一组”或“第二组”),理由是 、 、
。
高中样本分析考试
化学试卷参考答案
1.D 2.B 3.C 4.C 5.A 6.B 7.C 8.A
9.AC 10.AB 11.CD 12.D 13.D 14.BC
15.②④⑥⑧(4分,少一个正确答案扣一分、错选一个倒扣一分扣完为止)
16.⑴D ⑵C ⑶D ⑷镁粉、铁粉与NaCl的水溶液构成了原电池 (每空2分)
17.⑴>7(1分) ⑵无色溶液变成蓝色(1分) AsO![]() +2H++2e-=AsO
+2H++2e-=AsO![]() +H2O(2分)
+H2O(2分)
⑶I2+AsO![]() +H2O=2H++2I-+AsO
+H2O=2H++2I-+AsO![]() 或I2+AsO
或I2+AsO![]() +2OH-=H2O+2I-+AsO
+2OH-=H2O+2I-+AsO![]() (2分)
(2分)
⑷(或或其它有效表达式)(2分)
18.⑴Al2O3(2分) CO(NH2)2(2分)
⑵N2+Al2O3+3C ![]()
![]() 3CO+2AlN(2分)
3CO+2AlN(2分)
⑶AlN+OH-+H2O=AlO![]() +NH3↑(2分)
+NH3↑(2分)
⑷④⑦(2分,少一个正确答案扣1分、错选一个倒扣一分扣完为止)
19.Ⅰ.8(1分) 8(1分)
Ⅱ.能(1分) 分子中含有羟基和氨基等多个亲水基(1分)
两性(1分) 分子中同时具有酸性基团酚羟基和碱性基团氨基(1分)
Ⅲ.⑴C9H9NO4(2分) ⑵⑤(1分) 还原(1分)
⑶
 (2分)
(2分)
20.⑴为还原铁矿石提供热量(1分) 1∶2(1分)
⑵①CO+2H2=CH3OH(1分) 原子利用率为100%(1分)
②2CO+4 H2=CH3OCH3+H2O(1分) 3CO+3H2=CH3OCH3+CO2 (1分)
⑶可行(1分) 因为原料易得、原料利用率高、中间产物能有效地循环利用、产品结构的多样化(只要答出任意一点合理答案即可得1分)
21.⑴2 CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1452.8kJ·mol-1(3分,△H计算错误扣2分)
⑵a=-(6×391-3×436-945)=-93(3分)(计算关系正确给2分,结果正确给1分)
⑶△H=(4△H1+△H2-△H3)/2=+226.7kJ·mol-1(4分,计算关系正确给3分,结果正确给1分)
22A.⑴、C2H2、HCN、CO(2分) N2 (1分) CO(1分) ![]()
![]() (2分)
(2分)
⑵sp3(2分) sp2(2分) ⑶1∶2(2分)
B.⑴Cu+4 H++2NO![]() =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
或3Cu+8H++2NO![]() =3Cu2++2NO↑+4H2O (2分)
=3Cu2++2NO↑+4H2O (2分)
⑵防止倒吸(1分) 有害气体能被完全吸收(1分)
⑶①坩埚(1分) ②b(1分) ③防止双氧水分解(1分) 酒精与水互溶且极易挥发,减少晶体溶解(1分) ④第二组(1分) 第一组方案1需要灼烧,多消耗能源(1分);第一组方案2所得产品含有铁元素杂质(1分);而第二组方案几乎不产生有害气体,且所得产品纯度较高(1分)