中学化学习题汇编《氧族元素》迎考部分
选 择 题
1.常温下,向20升真空容器中通入a摩尔硫化氢和b摩尔氯气(a和b都是正整数,且均小于或等于5),反应完全后,容器内气体可能达到的最在密度是-----(B)
A.19.45克/升 B.18.25克/升 C.17.85克/升 D.35.5克/升
〖提示〗:氯气在与硫化氢反应时,不管氯气过量与否,其中的氯元素始终存在于气体中,当氯化氢取最大值(b=5)时才符合题意,同时,考虑到与氯元素结合的氢越多,气体的质量也越大,密度值也越大,所以硫化氢在允许的前提下也是越大越好(a=5),可求得此时气体的密度为18.25克/升,答案为B。如果反过来考虑:硫化氢中的氢元素也始终存在于气体中,硫化氢理当取最大值,氯元素的量也应该最大,同样也可推得答案为B.[经计算,当a:b的值为1:5.45(不是正整数,不符合题意)时,为A; 当a:b的值为5:5时,为B; 当a:b的值为1:5时,为C; 当a:b的值为0:n时(此时不是混和气体,全是氯气,已不符合题意),气体的密度为17.75克/升,所以D是无论如何也达不到的.
2.用足量的氢气和氧气分别跟m克硫反应,并将生成物混和,可生成的硫为----------------------------------------------------------------------------------------------------(B)
A.2m克 B.1.5m克 C.m克 D.0.5m克
3.为除去SO2中混有的少量SO3,并使所得物质的平均分子量尽可能地增大,应选用的物质是----------------------------------------------------------------------------(D)
A.亚硫酸钠溶液 B.亚硫酸氢钠溶液 C.碱石灰 D.浓硫酸
〖提示〗:浓硫酸与SO3生成H2SO4·nSO3
4.工业上从含硒废料中提取硒的方法是用H2SO4和NaNO3处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸即转化为亚硒酸(2HCl+H2SeO4 = H2SeO3+Cl2+H2O),再通入SO2于亚硒酸的溶液中,单质硒柝出,据此下列叙述正确的是------------------------------------------------------------------------------------------(AB)
A. H2SeO4的氧化性强于Cl2 B.亚硒酸的氧化性强于亚硫酸
C.SeO2还原性强于SO2 D.柝出1摩尔硒,1摩尔SO2
5.298K时,向V升真空容器中通入n摩SO2和m摩H2S。若5n=m,且反应后氧化产物与还原产物的质量和为48克,则n与m之和为------------------------(C)
A.1 B.2 C.3 D.4
〖提示〗:硫化氢过量1.5摩
6.已知白磷与氧气可发生如下反应:P4+3O2
== P4O6 P4+5O2
== P4O10,现在某密闭容器中加入62克白磷和50.4升氧气(标准状况),使之恰好完全反应,则所得到的P4O10与P4O6的物质的量之比为-----------------------------------------(C)
A.1:3 B.3:2 C.3:1 D.1:1
7.磷和氧气的反应,在两个容器中分别控制不同条件按如下两种形式进行反应: P4+3O2
== 2P2O3 P4+5O2
== 2P2O5。若在两容器中分别放入1摩磷和1摩氧气,经充分反应,分别得到P2O3 与P2O5的物质的量之比为----------------(C)
A.1:1 B.2:1 C.5:4 D.5:3
8.把11.9克H2S和11.2升(标准状况)O2,在一密闭容器中混和,在一定条件下充分反应后,测知反应物无剩余,再回复到原来状况,则容器中氧化产物的总质量是------------------------------------------------------------------------------------------(C)
A.10.8克 B.11.2克 C.21.6克 D.22.4克
〖提示〗: H2S和O2的反应可能有两种情况(反应式略),氧化产物可能是硫或二氧化硫或这两者的混和物。由氢元素的质量守恒有:水的质量=![]() 克,则氧化产物的质量=11.9+
克,则氧化产物的质量=11.9+![]() -6.3=21.6克。
-6.3=21.6克。
9.常温下,H2S与O2两气体混和,充分燃烧后H2S无剩余,恢复到原来的状态时,所得SO2的气体体积是原H2S气体体积的三分之一。则原H2S与O2的体积比是-------------------------------------------------------------------------------------------(B)
A.1:3 B.6:5 C:5:6 D.4:3
〖提示〗:依据氧原子和硫原子在反应前后的原子个数不变这一规律。设生成的SO2的体积为a,同化学方程式为:
3aH2S+![]() O2 == aSO2+2aS+3aH2O
O2 == aSO2+2aS+3aH2O
则![]()
10.将x 摩 Na2SO3和y摩 Na2S溶于水中,用硫酸酸化后,①若生成S和SO2,②若生成S和H2S,③若只生成S,则x:y的值依次为------------〖B〗
A.>![]() ,=
,=![]() ,<
,<![]() B.>
B.>![]() ,<
,<![]() ,=
,=![]()
C.=![]() ,>
,>![]() ,<
,<![]() D.<
D.<![]() ,>
,>![]() ,=
,=![]()
11.工业上从含硒的废料中提取硒的方法之一是:用硫酸和硝酸处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸
(2HCl + H2SeO4 == H2SeO3 + Cl2 + H2O),通SO2于亚硒酸溶液中,有单质硒析出。据此,下列说法正确的是----------------------------------------------------[B]
A、H2SeO4氧化性弱于Cl2 B、亚硒酸氧化性强于亚硫酸
C、SeO2还原性强于SO2
D、析出1molSe,需H2SeO3、SO2、H2O各1mol
12.
填 空 题
1.由常见元素组成的化合物A、B、C、D、E、F有如图所示的关系,其中C、F、G是无色的,D是氯化物。
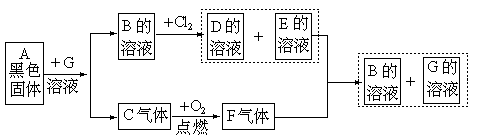
试确定A、B、C、G物质的化学式:
A【答:FeS】,B【答:FeSO4】,C【H2S】,G【答:H2SO4】
2.有一亚硫酸钠,可能已经变质。现将亚硫酸钠试样烘干后,称取a克,用蒸馏水溶解,加足量硝酸钡溶液,滤出生成的沉淀,洗净、干燥,得沉淀b克,试写出下列三种情况b与a的关系式:
(1)当亚硫酸钠没有变质时【答:![]() 】
】
(2)当亚硫酸钠部分变质时【答:![]() 】
】
(3)当亚硫酸钠完全变质时【答:![]() 】
】
3.足量的浓硫酸中加入a克铜,完全反应放出b升气体;足量的稀盐酸中加入m克FeS,完全反应放出n升气体(气体体积均在标况下测定)。已知两者生成的气体正好完全反应,则a:m:b:n=【答】:4:11:7:14
4.下图为固体物质A及其产物发生的一系列反应的框图,每一个方框内表示有一种反应物或生成物(反应条件及反应所需和生成的水均已略去),其中A、G为反应物,C、F在常温下均为气体:
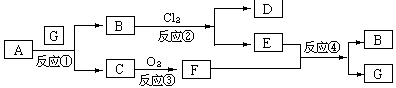
(1)试写出B和C的分子式:【答】:B为FeSO4 C为H2S
(2)写出把F通入到E物质的水溶液中所发生的反应④的离子方程式:
【答】:SO2+2Fe3++2H2O == 2Fe2++SO42-+4H+
5.(1)已知反应2H2S+O2 == 2H2O+2S 2H2S+3O2 == 2H2O+2SO2 S+O2 == SO2,设n代表物质的量,则当比值:
【提示】:H2S与O2的总反应可表示如下:
xH2S+yO2
== ![]() S+
S+![]() SO2+xH2O,以上各个结果均可由对该式的讨论得到。
SO2+xH2O,以上各个结果均可由对该式的讨论得到。
(2)在相同状况下,50毫升H2S和60毫升O2混和,当完全反应后,在同温同压下生成SO2 :
【答】:35毫升。
〖提示〗:可采用直接配平法。
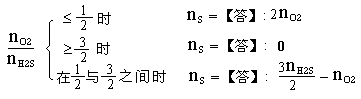
6.有两种无机盐A和B,其分子量都120,为了确定A和B,将它们分别溶于水制成溶液,进行下列实验:①将两种溶液混和立即产生一种易溶于水、易液化的气体;②在两种溶液中分别加入氯化钡溶液,A溶液无沉淀产生,B溶液里有白色沉淀柝出;③在两种溶液里分别加入过量的氢氧化钡溶液均有白色沉淀产生,请确定A、B两种盐的名称。
【解】:A:亚硫酸氢钾 B:硫酸氢钠
7.将x摩尔H2S和1摩尔O2置于一个容积可变的容器内进行反应,维持容器内气体的压强不变(101千帕),在常温下测得反应前后容器内气体密度分别为d1和d2,若x的取值不同,则H2S的氧化产物可能有以下三种情况:(忽略气体的溶解)
(1)全部是SO2,此时的x的取值范围是 ,且d1 d2(填大于、等于、小于)
(2)全部是S,此时x的取值范围是
(3)部分是S,部分是SO2,此时x的取值范围是 ,容器内气体的物质的量为 摩(用含x的关系式表示)
【解】:该反应的化学方程式可表示如下:
xH2S+1O2 = ![]() SO2+
SO2+![]() S+xH2O
S+xH2O
(1)当氧化产物全部是SO2,此时![]() =0,由此可得当氧气不过量时x=
=0,由此可得当氧气不过量时x=![]() ,考虑到氧气可以 过量,所以x值的合理取值范围应是x£
,考虑到氧气可以 过量,所以x值的合理取值范围应是x£![]() ;同时可以发现,反应后生成的SO2的分子量比H2S大,所以反应后气体密度增大,所以d1<
d2
;同时可以发现,反应后生成的SO2的分子量比H2S大,所以反应后气体密度增大,所以d1<
d2
(2) 当氧化产物全部是S,此时, ![]() =0,x=2,考虑到要满足H2S过量这一条件,所以x³2
=0,x=2,考虑到要满足H2S过量这一条件,所以x³2
(3)x值介于(1)与(2)这间,也就是![]() <x<2
<x<2
8.酸雨主要是燃烧含硫燃料时释放出SO2所造成的。现取一份雨水样品,每隔一定的时间测定其PH值,测定结果见附表
附表 雨水样品PH值随时间的变化值
| 测试时间(h) | 0 | 1 | 2 | 4 | 8 |
| 雨水样品PH值 | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
试说明雨水样品PH值减小的原因
〖提示〗:由上述数据可见,开始时样品的PH值随时间的推移而减小,一定时间后雨水样品的PH值不再发生变化。对于某一份在实验室里待测的雨水言,二氧化硫的继续溶解和挥发均可忽略不计,那么,其水溶液PH值的降低只能是它被空气中的氧气氧化成硫酸(强酸)所致:2SO2+2H2O+O2
== 2H2SO4。一定时间后,样品中的二氧化硫反应完全,PH值趋稳定。
9.某无色溶液可能含有下列钠盐中的几种:(A)氯化钠(B)硫化钠(C)亚硫酸钠(D)硫代硫酸钠(E)硫酸钠(F)碳酸钠。向此溶液中加入适量稀硫酸,有浅黄色沉淀析出,同时有气体产生。此气体有臭鸡蛋气味,可使澄清的石灰水变浑浊,不能使品红试液褪色。根据上述实验现象回答下列问题:
(1)不能使品红试液褪色,说明该气体中不含【答:SO2】(填分子式)。
(2)此无色溶液至少存在哪几种盐?请写出全部可能的情况(填写相应的字母):
第一种情况是:【答:B、C、F】
第二种情况是:【答:B、D、F】
第三种情况是:
第四种情况是:
10.工业上产生的硫化氢要经处理成硫后方能排放,以防止大气污染。富玛克斯法治理硫化氢的方法和步聚如下:
(1)用2%~3%的Na2CO3溶液做吸收剂生成两种酸式盐
(2)再加入一种RNO(R表示芳香族有机物的基)与生成的一种酸式盐的水溶液反应生成硫、碱和R-NH-OH
(3)第(2)步生成的碱在溶液中与另一种酸式盐反应生成正盐
(4)R-NH-OH与空气中的氧发生反应又得到RNO
试写出以上四步反应的化学方程式
【答】:(1)Na2CO3+H2S
== NaHCO3+NaHS
(2)NaHS+RNO+H2O ==
S+NaOH+R-NH-OH
(3)NaOH+NaHCO3
== Na2CO3+H2O
(4)2R-NH-OH+O2
== 2RNO+2H2O
11.近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,第一步是用Na2SO3吸收SO2;第二步是加热吸收液,使之重新生成Na2SO3,
同时得到含高浓度SO2的水蒸汽副产品,试写出上述两步反应的化学方程式。
【答:Na2SO3+SO2+H2O
= 2NaHSO3、2NaHSO3 == Na2SO3+SO2+H2O】
12.人体里的氧元素的质量占休重的65%,而氧原子的原子百分含量为25.5%;已知碳原子的百分含量为9.5%,则碳元素占体重的【答:18.16%】
〖提示〗:原子个数比=物质的量之比,所以,![]()
![]() ,也就有下列关系:
,也就有下列关系:
![]() 解得X=18.16
解得X=18.16
13.实验测得化合物A中各元素质量百分组成为钾a%,硫b%,其余是氧;B中含钾d%,硒e%,其余是氧,若A、B的化学式相似,且已知硫原子量为32,则硒的原子量是多少?【答:Se的原子量=![]() 】
】
〖提示〗:由于化学式相似,故有如下的表示式:
![]() ,可以解得:Se的原子量=
,可以解得:Se的原子量=![]()
14.把29克铁和硫的混和物在密闭条件下加热反应,冷却至室温,再加入足量稀硫酸后,放出的气体在标准状况下为8.4升,则混和物中硫和铁的物质量之比为【答:硫:铁=3:2】
〖提示:产生的气体体积只与铁的量有关,而与硫的量无关〗
15.将a摩H2S和1摩O2置于一个密闭容器中在120℃时反应,a的取值范围是【答:![]() 】;反应后生成SO2和H2O(气)的物质的量之和为【答:1+
】;反应后生成SO2和H2O(气)的物质的量之和为【答:1+![]() 】摩。
】摩。
〖提示〗:可采用直接配平法:
aH2S+O2=![]() SO2+
SO2+![]() S+aH2O
S+aH2O
可见n(SO2)+n(H2O)=![]() +a=1+
+a=1+![]()
16.
某地有软锰矿和闪锌矿两座矿山,它们的主要成份为:
软锰矿:MnO2含量≥65% Al2O3含量为4%
闪锌矿:ZnS含量≥80% FeS、CuS、CdS含量各为2%
MnO2和锌是制造干电池的主要原料。
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液经净化后再进行电解,MnO2在电解池的阳极析出。
电解锌的传统生产工艺为:闪锌矿高温氧化脱硫再还原得粗锌:
2ZnS+O2![]() 2ZnO+2SO2 2C+O2
2ZnO+2SO2 2C+O2![]() 2CO
2CO
ZnO+CO![]() Zn(g)+CO2
Zn(g)+CO2
将用热还原法制得的粗锌溶于硫酸,再电解ZnSO4溶液可生产纯度为99.95%的锌。
90年代生产MnO2和锌的新工艺主要是通过电解获得MnO2和锌,副产品是硫、金属铜和镉。简化流程杠图如下:
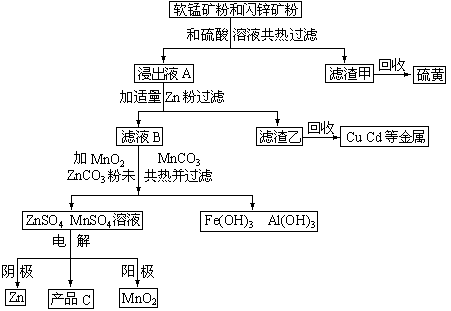
试回答下列问题:
(1)软锰矿、闪锌矿粉未与硫酸溶液共热时析出硫的反应为氧化-还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S¯+2H2O,据此写出MnO2在酸性溶液中分别和CuS、FeS和CdS发生氧化-还原反应的化学方程式:
【答】:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S¯+2H2O
MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S¯+6H2O
CdS+3H2SO4+MnO2=MnSO4+CdSO4+S¯+2H2O
软锰矿中Al2O3溶于硫酸的离子方程式:
【答】:Al2O3+6H+=2Al3++3H2O
(2)用离子方程式表示浸出液A与适量Zn粉作用得到滤液B与滤渣乙的过程
【答】:Zn+Cu2+=Cu+Zn2+ Zn+Cd2+=Cd+Zn2+ Zn+2Fe3+=2Fe2++Zn2+
(3)产品C的化学式是【答:H2SO4】
(4)试从环境保护和能量消耗的角度评价90年代新工艺相比较有哪些优点。
【答】:从环境保护角度评价:无SO2对大气的污染;从能量消耗角度评价:无高温焙烧热污染,不需要高温焙烧节约燃料。
17.
计 算 题
1.现有硫酸和硫酸钠的混和溶液200升,其中硫酸的浓度为1摩/升,硫酸钠的浓度为0.5摩/升,要使硫酸和硫酸钠的浓度变为2摩/升和0.2摩/升,应加入55.8%的硫酸溶液(d=1.35 g/升)多少升后再加蒸馏水配制?
【解】:由于硫酸钠在配制前后总量没有发生变更,所以可根据最后它的浓度, 先求出最后溶液的体积V
0.2×0.5/V=0.2
解得V=0.5升(500升)
此时硫酸的总量应为0.5×2=1 摩
原先硫酸的量为0.2×1=0.2摩
需重新加入的硫酸量为1-0.2=0.8 摩
设需加入的硫酸体积为X 升
则有 1.35×X×55.8%=98×0.8
解得 X=104.1 升
2.焙烧1.10克黄铁矿,将形成的焙砂在氢气流中加热使其充分反.这样得到的物质在加热下用过量盐酸处理,向此溶液中加入双氧水并用氨饱和.定量地分离出形成的沉淀,将其溶解在盐酸中,加入过量的碘化钾.为了使得到的溶液褪色,准确地消耗了50升0.1摩/升的硫代硫酸钠溶液.
⑴写出所有的化学反应方程式
⑵计算黄铁矿中杂质的含量(假设所有反应都是定量进行的)
【解】:⑴4FeS2 +11O2 =2Fe2 O3 +8SO2
Fe2 O3 +3H2 =2Fe+3H2 O
Fe+2HCl=FeCl2 +H2 ↑
2FeCl2 +H2 O2 +4NH3 +4H2 O=2Fe(OH)3 ↓+4NH4 Cl
Fe(OH)3 +3HCl=FeCl3 +3H2 O
2FeCl3 +2KI=2FeCl2 +I2 +2KCl
I2 +2Na2 S2 O3 =Na2 S4 O6 +2NaI
⑵按反应I2+2Na2S2O3 =Na2S4O6 +2NaI可求得滴定碘时消耗了硫代硫酸钠的量为0 005摩.1摩硫代硫酸钠相当于1摩黄铁矿,因此,黄铁矿的量也是0.005摩(0.6克).杂质的含量为1.10-0.6=0.5克
杂质的百分含量为0.5/1.1=0.454即45.4%
3.将硫化氢和氧气的混和气体通入温度为220℃的密闭容器中,在高温下使之燃烧,反应后再恢复到原温度,测得此时容器中气体的压强比起始时减少28.6%。问:
(1)在容器中硫化氢发生的是完全燃烧还是不完全燃烧?
(2)原混和气体中硫化氢所占的体积百分数是多少?
【解】:如果反应完全按下式进行(氧气过量):
2H2S+3O2 == 2SO2+2H2O----① 则反应后的体积的减少量=![]() <28.6%
<28.6%
如果反应完全按下式进行(硫化氢过量):
2H2S+O2 == 2S+2H2O---------② 则反应后的体积的减少量=![]() >28.6%
>28.6%
由此可以推断题中给出的反应可能是①、②两反应的加合或者是只按反应②进行且硫化氢过量(说明:生成的硫单质在该温度下不是气体;)
现分两种情况加以讨论:
第一种情况:完全按反应②进行且硫化氢有剩余
设氧气为1体积,硫化氢为(2+a)体积(2体积参加反应,a体积剩余),则反应前气体的总体积为(2+a+1)由反应②可以知道,反应后气体体积为生成的水蒸气和剩余的硫化氢组成的混和物,其体积为(2+a),由题意可列出:
=71.4%=H2S%(说明:不用解出来,因为此表达式就是H2S%)
第二种情况:①、②两个反应同时进行,产物中既有S又有SO2,反应物没有剩余
设硫化氢为1体积,氧气为a体积,直接配平反应:
1H2S+aO2
== ![]() S+
S+![]() SO2+1H2O
SO2+1H2O
由题意: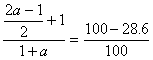 解得:a=1.8
解得:a=1.8
所以H2S%=![]() =57.2%
=57.2%
4.某空气污染监测仪是根据SO2和Br2的定量反应来监测空气中SO2含量的。其中Br2来自一个装满有酸性(H2SO4)溴化钾溶液的电解槽阳极上的氧化反应,电解槽阳极室与阴极室是隔开的。测某地区空气中的SO2含量时,空气经过机械除尘以1.5×10-4米3/分的流速进入电解槽的阳极室 ,电流计上测得每秒通过的电子是8.56×10-11摩,能保持溴浓度恒定并恰好与SO2完全反应,若被测空气中不含有其它与溴反应的物质:
(1)写出监测过程中所发生的主要反就的化学方程式:
![]()
(2)计算该地区空气中SO2的含量(克/米3空气)【答:1.096×10-3克/米3】
5.常温常压下,50毫升H2S与60毫升O2混和点燃充分反应后恢复到原状态,可生成SO2多少毫升?
〖分析〗:H2S燃烧的化学方程式有以下两种形式:
①氧气不足时:2H2S+O2
= 2S+2H2O
②氧气充足时:2H2S+3O2
= 2SO2+2H2O
因为![]() ,所以生成物中既有单质S,又有SO2存在。
,所以生成物中既有单质S,又有SO2存在。
【解一】:正向推导法
假如先发生反应①,则50毫升H2S中的S全部转变成单质S,同时消耗O225毫升,剩余的35毫升O2再与部分S发生反应S+O2 =
SO2,显然,当O2消耗完时,生成SO2的体积为35毫升。
【解二】:逆向推导法
假定先发生反应②,60毫升O2消耗完时可生成SO240毫升,同时消耗H2S40毫升,剩余10毫升H2S再与部分SO2发生反应2H2S+SO2
= 3S+2H2O,显然,该反应又消耗SO25毫升,则最后得到的SO2体积=40-5=35毫升。
【解三】:列方程组法
设发生反应①的H2Sx毫升,发生反应②的H2S为y毫升,据题意有:
![]() 解得
解得![]()
35毫升H2S按②式反应得到SO2的体积肯定是35毫升。
【解四】:直接配平法
分析题意可知,在反应过程中,H2S与O2两者均完全消耗完,所以可以用直接配平法进行解题:
50H2S+60O2
= 15S+35SO2+50H2O
上式表明:该反应中生成的SO2的体积为35毫升。
【解五】:差量法
H2S与O2反应生成液态水,无论发生反应①还是发生反应②,气体总体积的减少都是原H2S体积的![]() 倍,本题中即减少50×
倍,本题中即减少50×![]() =75毫升,由于最终剩余的气体只有SO2,所以SO2气体的体积=50+60-75=35毫升。
=75毫升,由于最终剩余的气体只有SO2,所以SO2气体的体积=50+60-75=35毫升。
【解六】:十字交叉法
恰好发生不完全燃烧时O2与H2S的体积之比为![]() ,恰好发生完全燃烧时O2与H2S的体积之比为
,恰好发生完全燃烧时O2与H2S的体积之比为![]() ,本题中O2与H2S的体积比为,利用十字交叉法:
,本题中O2与H2S的体积比为,利用十字交叉法:

得发生反应①的H2S与发生反应② 的H2S的体积之比为![]() ,故发生反应②的H2S为50×
,故发生反应②的H2S为50×![]() =35毫升,可知生成SO2的体积为35毫升。
=35毫升,可知生成SO2的体积为35毫升。
【解七】:以50毫升H2S燃烧为基础作图:当O2为25毫升时开始生成SO2,当O2为75毫升时生成 SO2达到最大值(50毫升),从y轴中找到与x轴的“60”该值相对应的值是35,这说明生成SO2的体积为35毫升。
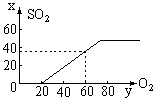
6.接触法制硫酸排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前没法进行综合利用。
(1)某硫酸厂每天排放的10000立方米尾气中含有0.2%(体积百分数)的二氧化硫,问用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克石膏(CaSO4·2H2O)?
(2)如果将一定体积的尾气通入100毫升2摩/升的氢氧化钠溶液使其完全反应,经测定所得溶液含有16.7克溶质。试分析该溶液的成分,并计算确定各成分的物质的量。
(3)工厂在尾气处理制石膏的过程中,中间产物是亚硫酸氢钠。调节尾气排放的流量,以取得二氧化硫与氢氧化钠间物质的量最佳比值,从而提高亚硫酸氢钠的产量。现设n(SO2)、n(NaOH)、n(NaHSO3)分别表示二氧化硫、氢氧化钠和亚硫酸氢钠的物质的量,且![]() =x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式(不要求全部填满)。
=x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式(不要求全部填满)。
| x | n(NaHSO3) |
〖提示〗:对于(2),先确定反应的产物是NaHSO3与Na2SO3的混和物,设这两种物质的物质的量分别是x、y,可列出下式:
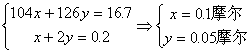
对于(3)可以运用分段讨论法,根据发生的反应,可确定![]() 、
、![]() 两个分界点,从而产生x£1、
两个分界点,从而产生x£1、![]() <x<1、x³1三个区域,然后再进一步讨论,最后可得:
<x<1、x³1三个区域,然后再进一步讨论,最后可得:
| x | n(NaHSO3) |
| x£ | 0 |
|
| 2n(SO2)-n(NaOH) |
| x³1 | n(NaOH) |
7.
某碳酸钙、亚硫酸钙的混和物,经分析知含钙的质量分数为36%,求其中的含碳、硫、氧的质量分数各是多少?
【解】(1)由碳酸钙、亚硫酸钙的化学式可知:
O%=![]()
(2)设碳酸钙与亚硫酸钙的物质的量之比为1:X,则依题意得:
Ca%=![]() ,解得X=1.25
,解得X=1.25
S%=![]()
C%=![]()
8.接触法制硫酸是先把SO2催化氧化成SO3,然后用水和浓硫酸吸收。某工厂接触室“出口气体”中含有N2、O2和少量SO2及体积分数为10%的SO3。把“出口气体”送进吸收塔,使SO3转化成发烟硫酸(可以看作是H2SO4与SO3的混和物),其中SO3的质量分数为20%。请计算:
(1)若发烟硫酸用H2SO4·xSO3表示,则x的值是多少?
(2)若只用水吸收SO3(假设吸收完全)生产该发烟硫酸,求出448立方米(已折算成标准状况)“出口气体”所需用水的质量。
(3)若只用98%的浓硫酸来完全吸收SO3生产发烟硫酸,计算出448立方米(已折算成标准状况)“出口气体”所需用98%H2SO4的质量。
【答】:(1)0.306 (2)2.76×104克 (3)4.43×105
9.