高三化学期中试卷 99.11
一、 选择题:(每小题有一个或两个正确答案)
1.
在N2+3H2 ![]() 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/l,在此段时间内用H2表示的平均反应速率为0.45mol/(l·s),则此段时间是:
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/l,在此段时间内用H2表示的平均反应速率为0.45mol/(l·s),则此段时间是:
| A.1s | B.2s | C.0.44s | D.1.33s |
2. 已知4NH3+5O2=4NO+6H2O,若反应速率分别用VNH3,VO2,VNO,VH2O [mol/(l·min)]表示,则正确的关系是:
| A.4 VNH3=5 VO2 | B.5 VO2=6 VH2O | C.3VNH3=2 VH2O | D.4 VO2=5 VNO |
3. 把下列A、B、C、D、四种不同体积和浓度的X溶液分别加入四个盛有10ml、2mol/l盐酸的烧杯中,并加水稀释至50ml,此时X和盐酸进行反应,其中反应速率最大的是:
| A.10ml,4mol/l | B.10ml,2mol/l | C.20ml,3mol/l | D.20ml,2mol/l |
4.
在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应
A(固)+2B(气)![]() C(气)+D(气)已达平衡的是:
C(气)+D(气)已达平衡的是:
| A.混合气体的压强 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.气体的总物质的量 |
5.
在密闭容器中发生反应:aX(气)+bY(气)![]() cZ(气)+dW(气)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是:
cZ(气)+dW(气)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是:
| A.平衡向逆反应方向移动 | B.a + b > c + d |
| C.Z的体积分数增加 | D.X的转化率下降 |
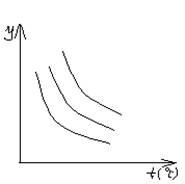 6.如图表示外界条件(温度、压强)的变化对反应影响, L(固)+G(气)
6.如图表示外界条件(温度、压强)的变化对反应影响, L(固)+G(气)![]() 2R(气)– Q(Q>0),在图中,y轴指:
2R(气)– Q(Q>0),在图中,y轴指:
| A.平衡混合气中R的百分含量 |
| B.平衡混合气中G的百分含量 |
| C.G的转化率 |
| D.L的转化率 |
7.能说明醋酸是弱电解质的依据是:
| A.醋酸能与碳酸钠反应,并有二氧化碳气体生成。 |
| B.醋酸溶液能使紫色石蕊试液变红。 |
| C.用醋酸溶液做导电性实验时,灯泡较暗。 |
| D.在pH值相同的醋酸和盐酸中,前者的物质的量浓度较大。 |
8.一定量的盐酸跟过量的铁粉反应时,为了减慢反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的:
| A.NaOH固体 | B.H2O | C.NH4Cl固体 | D.CH3COONa固体 |
9.用水稀释0.1mol·L–1氨水时,溶液中随着水量的增加而减小的是:
| A.[OH–]/ [NH3·H2O] | B. [NH3·H2O]/[OH–] |
| C.[H+]和[OH–]的乘积 | D. OH–的物质的量 |
10.100ml某酸溶液,室温时,测得其pH =1,下列叙述正确的是:
| A.溶液中[H+]≥0.1mol·L–1 | B.把该溶液稀释成1L后,pH≥2 |
| C.把该溶液稀释成1L后,pH≤2 | |
| D.完全中和此溶液需0.1mol·L–1NaOH溶液的体积≥100ml | |
11.相同温度的两种稀氨水A和B,A溶液的浓度是c mol/l,电离度为α1;B溶液中[NH4+]为c mol/l,电离度为α2,则下列判断错误的是:
| A.A溶液中的[OH―]是B溶液中[OH―]的α1倍 |
| B.α1>α2 |
| C.B溶液的摩尔浓度可表示为c/α2 mol/l |
| D.A溶液的pH值大于B溶液的pH值 |
12.在RNH2·H2O![]() RNH3++OH―的平衡中,要使RNH2·H2O的电离度和[OH―]都增大,可采取的措施是:
RNH3++OH―的平衡中,要使RNH2·H2O的电离度和[OH―]都增大,可采取的措施是:
| A.通入HCl | B.加入少量NaOH固体 | C.加水 | D.升温 |
13.某温度下,0.02 mol·L–1的盐酸跟0.01 mol·L–1的氢氧化钡溶液等体积混合后,得到的溶液中下列结论肯定正确的是:
| A.pH=7 | B.KW=10–14 | C.[H+]=[OH–] | D.[H+]>10–7 mol·L–1 |
14.pH值相同的等体积的盐酸、硝酸和醋酸,分别与足量的锌反应,产生氢气的体积为:
| A.盐酸最多 | B.醋酸最多 | C.盐酸和硝酸一样多 | D.三者一样多 |
15.C1、C2、α1、α2、pH1、pH2分别表示两种一元弱酸的物质的量浓度、电离度和溶液的pH值。如果已知pH1< pH2且α1>α2,则C1和C2的关系是:
| A.C1> C2 | B.C1= C2 | C.C1< C2 | D.无法确定 |
16.在室温下,下列等体积的酸和碱的溶液混合后,pH值一定等于7的是:
| A.pH=3的硝酸跟pH=11的氢氧化钾的溶液 |
| B.pH=3的盐酸跟pH=11的氨水 |
| C.pH=3的硫酸跟pH=11的氢氧化钠的溶液 |
| D.pH=2的醋酸跟pH=11的氢氧化钡的溶液 |
17.在一定条件下发生下列变化,其中不属于盐类水解反应的是:
| A.HS–+H2O | B.HCO3–+H2O |
| C.MgCO3+2H2O | D.AlO2–+2H2O |
18.氯化铁溶于水,达到水解平衡后,若要提高水解程度,则应:
| A.加热 | B.加水 | C.加少量盐酸 | D.降温 |
19.物质的量浓度相同的三种盐NaX、NaY、和NaZ的溶液,其pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是:
| A.HX、HZ、HY | B.HZ、HY、HX | C.HX、HY、HZ | D.HY、HZ、HX |
20.物质的量浓度相同的下列溶液中,NH4+ 浓度最大的是:
| A.NH4Cl | B.NH4HSO4 | C.CH3COONH4 | D.NH4HCO3 |
21.在物质的量浓度均为0.01 mol·L–1的 CH3COOH,CH3COONa的混合液中,测得[CH3COO–]>[Na+],则下列关系式正确的是:
| A.[H+]>[OH–] | B.[H+]<[OH–] |
| C.[CH3COOH]>[ CH3COO–] | D.[CH3COOH] +[CH3COO–] =0.02mol·L–1 |
22.在25℃时,pH值等于11的NaOH溶液和NaCN溶液中水的电离度大小比较正确的是:
| A.相等 | B.后者比前者大11倍 |
| C.后者是前者的108倍 | D.前者是后者的108倍 |
23.将100g 1%的氢氧化钠溶液和100g 1%的硫酸溶液混合后,滴入甲基橙指示剂后,溶液的颜色变为:
| A.红色 | B.橙色 | C.黄色 | D.无色 |
24.下列叙述正确的是:
| A.铜锌原电池中铜是正极 | B.用电解法精炼铜时粗铜作阴极 |
| C.在镀件上电镀铜时可用金属铜作阳极 | D.电解稀硫酸制H2、O2时可用铜作阳极 |
25.X、Y、Z、M代表四种金属元素。金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子。则这四种金属的活动性由强到弱的顺序为:
| A.X>Z>Y>M | B.X>Y>Z>M | C.M>Z>X>Y | D.X>Z>M>Y |
26.用石墨作电极,电解1 mol·L–1下列物质的溶液,溶液的pH值保持不变的是:
| A.HCl | B.NaOH | C.Na2SO4 | D.NaCl |
27.将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为:
| A.1 : 2 : 3 | B.3 : 2 : 1 | C.6 : 3 : 1 | D.6 : 3 : 2 |
28.用惰性电极电解M(NO3)x的水溶液,当阴极增重a克时,在阳极上同时产生b升氧气(标准状况),从而可知M的相对原子质量为:
| A.22.4ax / b | B.11.2ax / b | C.5.6ax / b | D.2.5ax / b |
29.用石墨电极电解饱和CuSO4溶液,一段时间后断开电路,欲使溶液恢复到电解前的成份和浓度,应向其中加入适量的:
| A.CuSO4 | B.H2O | C.CuO | D.Cu(OH) 2 |
30.氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式H2+2NiO(OH) ![]() 2Ni(OH)
2 。根据此反应式判断,下列叙述中正确的是:
2Ni(OH)
2 。根据此反应式判断,下列叙述中正确的是:
| A.电池放电时,电池负极周围溶液的pH不断增大 |
| B.电池放电时,镍元素被氧化 |
| C.电池充电时,氢元素被还原 |
| D.电池放电时, H2是负极 |
二、 填空题:
31.一块碳素钢表面有一层薄薄的水膜,若这层水膜酸性很弱或显中性,则发生________腐蚀,其正极反应式为__________________,负极反应式为__________________,电池总反应式为_________________________;若钢铁表面的水膜呈酸性,则此时钢铁发生____________腐蚀,正极的电极反应式为____________________,负极的电极反应式为_____________________,电池总反应式为_______________,随着反应的不断进行,水膜酸性会____________,又将发生_____________腐蚀。
32.写出工业上用电解饱和食盐水制烧碱和Cl2的电极反应式:阳极_________________,阴极____________________,总的电解方程式为________________________________,工业上冶炼铝的化学方程式是_______________________________________,冰晶石作用是_______________,在电解过程中,需定期补充_____________________。
33.一定条件下可逆反应A2(气)+B2(气)![]() 2C(气)达平衡状态。测得[A2]=0.5 mol·L–1,[B2]=0.1 mol·L–1,[C]= 1.6 mol·L–1。若A2、B2、C的起始浓度分别为a mol·L–1、b mol·L–1、c mol·L–1,试回答:
2C(气)达平衡状态。测得[A2]=0.5 mol·L–1,[B2]=0.1 mol·L–1,[C]= 1.6 mol·L–1。若A2、B2、C的起始浓度分别为a mol·L–1、b mol·L–1、c mol·L–1,试回答:
(1)(a - b)应等于__________。
(2)a的取值范围是____________。
34.某温度下,纯水中的[H+]=2.0×10–7 mol·L–1,则此时[OH–]= ________ mol·L–1。若温度不变,滴入稀盐酸使溶液中[H+]=5.0×10–6 mol·L–1,则此时[OH–]= ________ mol·L–1 。
35.在25℃时,若10体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则混合之前,a与b应满足的关系是____________________。
36.从NO3–、SO42–、H+、Cu2+、Ba2+、Ag+、Cl– 等离子中,选出适当的离子组成电解质,采用惰性电极对其溶液进行电解:
(1) 若两极分别放出H2和O2,电解质的化学式可能是_________,________,________。
(2) 若阴极析出金属,阳极放出O2,电解质的化学式可能是________,_______,______。
(3) 若两极分别放出气体,且体积比为1:1,电解质的化学式可能是________,______。
37.用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,锥形瓶中通常盛放___________,可选用的指示剂是_____________,滴定时左手_______________,右手______________。
若已知盐酸物质的量浓度为m1 mol/l,滴定时消耗的体积为V1ml,氢氧化钠溶液的体积为V2ml,则氢氧化钠的物质的量浓度是____________。如滴定过程中进行如下操作,分别指出该操作对滴定结果的影响:(填“偏高”,“偏低”,或“无影响” )
(1) 滴定前,滴定管尖嘴处有气泡,滴定后气泡消失:__________
(2) 滴定管经蒸馏水洗涤后,即装入标准溶液进行滴定:__________
(3) 滴定前锥形瓶用蒸馏水洗涤后未用待测液润洗:__________
(4) 滴定管读数时,开始时仰视,结束时俯视:__________
三、计算题:
38.将0.05mol/l的盐酸和未知浓度的氢氧化钠溶液以1:2的体积比混合,所得溶液pH值为12,用上述氢氧化钠溶液滴定pH=3的某一元弱酸溶液20ml,达到终点时,消耗氢氧化钠溶液12.5ml,试求:
(1) 氢氧化钠溶液的物质的量浓度?
(2) 此一元弱酸的物质的量浓度?
(3) 此一元弱酸的电离度?
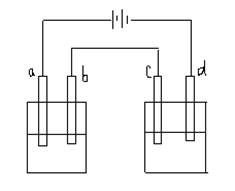
39.如图所示的电解装置中,A池盛有400ml饱和KCl溶液,B池盛有400ml饱和CuSO4溶液,四个电极都用惰性材料制成,通电一段时间后,B池中阴极增重0.64g,求:
(1)A、B两池中阳极上各产生什么气体?写出电极反应式,并计算标准状况下气体各为多少升?
(2)电解后,A、B两池中pH值各为多少?(设溶液体积不变,也不考虑溶液的水解)