高三化学试卷 (2)
可能用到的原子量:
H 1 He 4 C 12 N 14 O 16 Na 23
Mg 24 Al 27 S 32 Cl 35.5 Zn 65
一. 选择题:
1. 下列各组物质中,前者为附着在试管内壁的残余物,后者为某同学所选用的洗涤剂。
后者不能溶解前者的是 ( )
(A) 红磷 -- 二硫化碳
(B) 二氧化锰 -- 浓盐酸
(C) 苯酚 -- 氢氧化钠
(D) 油脂 -- 酒精
2. 下列说法中不正确的是 ( )
(A) 任何酸都不能与二氧化硅发生氧化-还原反应
(B) 二氧化硅是制造水泥的主要原料,它在高温下可与石灰石发生反应
(C) 二氧化硅属于原子晶体,具有四面体的空间网状结构
(D) 烟水晶的主要成分为二氧化硅
3. 由下列各组原子序数所表示的两种元素,能形成AB2型离子化合物的是( )
(A) 6和8 (B) 11和8
(C) 11和16 (D) 12和17
4. 1993年8月,国际原子量委员会确认,我国张青莲教授测定的锑原子量(121.760)为标准
原子量。已知锑有2种以上天然同位素,则121.760是 ( )
(A) 锑元素的质量与![]()
![]() 原子质量的
原子质量的![]() 的比值
的比值
(B) 一个锑原子的质量与![]() 原子质量的
原子质量的![]() 的比值
的比值
(C) 按各锑的天然同位素原子量和这些同位素所占的一定百分比计算出的平均值
(D) 按各锑的天然同位素质量数和这些同位素所占的一定百分比计算出的平均值
5. 在制玻璃、制皂、造纸、纺织等工业生产中都需要的物质是( )
(A) 氧化钙 (B) 纯碱
(C) 石灰石 (D) 氯化钠
6. 下列叙述中不正确的是( )
(A) 能跟酸反应的氧化物,不一定是碱性氧化物
(B) 凡具有正四面体结构的分子中,其键角均为109 度28分
(C) 有新单质生成的化学反应不一定都是氧化-还原反应
(D) 在100 ℃和1.01×10![]() 帕时,18克水蒸气含有6.02×10
帕时,18克水蒸气含有6.02×10![]() 个水分子
个水分子
7. 设N![]() 为阿伏加德罗常数,下列叙述正确的是(
)
为阿伏加德罗常数,下列叙述正确的是(
)
① 4克Ca变为Ca![]() 失去的电子数目为0.1N
失去的电子数目为0.1N![]()
② 在标准状况下,40克SO2所占的体积约为11.2升
③ 18克重水所含的电子数是9N![]()
④ 1.6克NH![]() 离子中含有的电子数为 0.8N
离子中含有的电子数为 0.8N![]()
(A) ①、② (B) ②、④
(C) ②、③ (D) ③、④
8. 有aX![]() 和 bY
和 bY![]() 两种简单离子(X、Y全都是短周期元素),已知X
两种简单离子(X、Y全都是短周期元素),已知X![]() 比Y
比Y![]() 多2个电子层,
多2个电子层,
下列关系或说法正确的是( )
① X只能是第三周期的元素 ② a-b+n+m 等于10 或者等于16
③ b不大于5 ④ Y不可能是第二周期元素
(A) ①、② (B) ②、④
(C) ②、③ (D) ③、④
9. 在下列各组物质中,全都是由分子构成的一组化合物是( )
(A) CO2, CH4, SiO2
(B) HNO3, C6H6, C12H22O11
(C) HO, H2O2, H2O
(D) NH3, NH3·H2O, NH4Cl
|
10. 具有解热镇痛及抗生素作用的药物“芬必得”, 其主要成分的结构式如图 它属于( ) |
(A) 芳香族化合物
(B) 苯甲酸的同系物
(C) 易溶于水的有机物
(D) 易升华的物质
11. 向25毫升18.4 摩/升硫酸溶液中加入足量的铜片并加热,等充分反应后,被还原的硫
酸的物质的量为 ( )
(A) 等于0.46 摩 (B) 大于0.23 摩,小于0.46 摩
(C) 等于0.23 摩 (D) 小于0.23 摩
12. 在25 度时,将等体积盐酸和氨水混和,若混和液中[NH![]() ]=[Cl
]=[Cl![]() ],
],
则溶液的pH值为 ( )
(A) 大小7 (B) 小于7
(C) 等于7 (D) 无法确定
13. 据报道,1994年11月9日德国科学家利用数亿个镍原子![]() 对数亿个铅原子
对数亿个铅原子![]() 连续轰击数天后,制得一种新原子
连续轰击数天后,制得一种新原子![]() (暂用X表示),它属于一种新元素—第110号元素。这种新元素是有史以来制得的最重要的元素,存在的时间不到千分之一秒。经分析,它属于过渡元素。下列关于该元素的叙述中正确的是( )
(暂用X表示),它属于一种新元素—第110号元素。这种新元素是有史以来制得的最重要的元素,存在的时间不到千分之一秒。经分析,它属于过渡元素。下列关于该元素的叙述中正确的是( )
①、 这种原子![]() 的中子数为159 ②、 这种元素肯定是金属元素
的中子数为159 ②、 这种元素肯定是金属元素
③、 这种元素与铅![]() 属同一族 ④、 这种元素属第六周期元素
属同一族 ④、 这种元素属第六周期元素
(A) ①、② (B) ②、④
(C) ②、③ (D) ③、④
14. 在Zn 跟稀硝酸反应时,若参加反应的Zn 与消耗的HNO3 的物质的量之比为1 :2.5时,
则被还原的HNO3和未被还原的HNO3的物质的量之比为 ( )
① 2 :5 ② 1 :4 ③ 1 :5 ④ 1 :9
(A) ①、② (B) ②、④
(C) ②、③ (D) ③、④
15. 用pH值相同的盐酸和醋酸溶液分别跟锌反应,若最后锌都已完全溶解,但放出的气体
样多,则下列判断正确的是( )
① 整个反应阶段平均速度:醋酸>盐酸
② 反应所需时间:醋酸>盐酸
③ 参加反应的锌的质量:盐酸=醋酸
④ 开始反应速度:盐酸>醋酸
(A) ①、② (B) ①、③
(C) ②、③ (D) ②、④
16. 在托盘天平两端各放一个质量相等的烧杯,内盛4 摩/升的盐酸溶液50 毫升,调节天
平使其平衡,分别向烧杯中加入下列各种物质,反应完毕天平仍为平衡的是( )
① 6.5克Fe和0.1摩Zn ② 0.1摩Fe和0.1摩Zn
③ 0.1摩Fe和5.6克Zn ④ 0.1摩Na和0.1摩Mg
(A) ①、② (B) ①、③
(C) ②、③ (D) ①、④
17. 将3 摩A 和2.5 摩B 充入容积为2升的密闭容器中,发生如下反应:
3A(气) + B(气) → nC(气) + 2D(气),5分钟时反应达平衡状态,生成1摩D ;
经测定,以C表示的平均反应速度为0.1摩/(升·分),
下列结论中错误的是( )
① 平衡时B 的转化率为20% ② 平衡时B 的浓度为1摩/升
③ 经计算,n值为1 ④ 用A 表示的平衡反应速度为0.3摩/(升·分)
(A) ①、② (B) ①、④
(C) ②、③ (D) ③、④
18. 在物质的量浓度相同的情况下,将相同体积的醋酸和氢氧化钠溶液混和后,下列对溶液
中各离子物质的量浓度的相互关系表达正确的是( )
① [CH![]() COO
COO![]() ]>[Na
]>[Na![]() ]>[OH
]>[OH![]() ]>[H
]>[H![]() ]
]
② [Na![]() ]>[CH
]>[CH![]() COO
COO![]() ]>[OH
]>[OH![]() ]>[H
]>[H![]() ]
]
③ [H![]() ]+[Na
]+[Na![]() ]=[CH
]=[CH![]() COO
COO![]() ]+[OH
]+[OH![]() ]
]
④ [Na![]() ]=[CH
]=[CH![]() COO
COO![]() ]>[OH
]>[OH![]() ]=[H
]=[H![]() ]
]
(A) ①、② (B) ①、④
(C) ②、③ (D) ③、④
19. 在一定温度下,R 的二价硫酸盐的饱和溶液的浓度为41.2%,再加入该无水盐1.0克到该饱和溶液中后,析出带7个结晶水的晶体7.74克。则该无水硫酸盐的化学式(分子式)为( )
(A) CuSO![]() (B) FeSO
(B) FeSO![]()
(C) ZnSO![]() (D) MgSO
(D) MgSO![]()
20. 化合物 R-CO-CH3 与NaOH溶液、碘水可发生如下反应
① I2 + 2NaOH = NaCl + NaIO + H2O
② R-CO-CH3 + 3NaIO → R-CO-CI3 + 3NaOH
③ R-CO-CI3 + NaOH → R-CO-O-Na + CHI3↓(黄色)
此反应称为碘仿反应。试根据上述反应推断下列物质中能发生碘仿反应的有( )
1. CH3CH2COCH2CH3 2. CH3CHO
3. CH3CH2CHO 4. CH3COC2H5
(A) 1,2 (B) 2,3
(C) 4,3 (D) 2,4
21. 在甲、乙、丙、丁四个烧杯内各放入0.1摩的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100毫升水。下列对固体完全溶解后所得各溶液的质量百分比浓度关系表达正确的是( )
(A) 甲<乙<丙<丁 (B) 丁<甲<乙=丙
(C) 甲=丁<乙=丙 (D) 丁<甲<乙<丙
22. 有一硫化钠、亚硫酸钠和硫酸钠的混和物,经测定,含硫25.6%,则此混和物含氧量为 ( )
(A) 37.6% (B) 36.8%
(C) 51.2% (D) 无法计算
23. 当25 ℃时,在下列相同摩尔浓度的溶液中,水的电离度由大到小排列正确的是( )
① KNO3 ② NaOH ③ NaCl ④ (NH4)2SO4
(A) ②>④>①=③ (B) ④>①=③>②
(C) ①=③>④>② (D) ④>②>①=③
24.某硝酸与过量的铁粉反应,共生成4.48升N2O 气体(在标准状况下),如改与铝粉反应(生
成NO气体),则最后可溶解铝为( )
(A) 13.5克 (B) 6.75克
(C) 2.7克 (D) 9.0克
25. 将金属镁、铝、铁的单质分别投入到质量相等、浓度相同的稀硫酸中,待反应结束后,
各溶液的质量仍相等,则投入的镁、铝、铁的质量比为( )
(A)![]() :
: ![]() :
: ![]() (B)
(B) ![]() :
: ![]() :
: ![]()
(C) ![]() :
: ![]() :
: ![]() (D)
(D) ![]() :
: ![]() :
: ![]()
二、分析题和实验题:
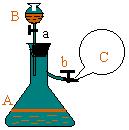
| 1. 如图所示,在支管锥形瓶A中充满等体积的H2S和NO气体;在分液漏斗B中盛有淀粉碘 化钾溶液;在锥形瓶的支管处用弹簧夹b夹紧,并充满O2的气球C。根据实验,填写:
|
(1).打开分液漏斗的活塞a,将漏斗中的溶液缓慢的流入A中,
发生的变化是:( H2S 气体溶于KI溶液中 )。
请判断:( )
(2).松开弹簧夹b,气球C逐渐_________,
锥形瓶A中的气体 颜色立即变成__________. ( )
(A)增大 棕色 (B)缩小 红色
(C)缩小 棕色 (D)增大 红色
(3).锥形瓶A中的溶液开始变混浊,这是因为______.
(用化学方程式表示)。 ( )
(A)2NO + O2 = 2NO2 (B) H2S + 2NO2 = 2HNO3 + S
(C)2KI + 2NO2 = 2KNO3 + I2 (D)以上都不对。
(4).锥形瓶A中的溶液开始变混浊,在溶液中变混浊的同时,
溶液出现浅蓝色,这是因为( )
(A)2NO + O2 = 2NO2 (B)H2S + 2NO2 = 2HNO3 + S
(C)2KI + 2NO2 = 2KNO3 + I2 (D)以上都不对。
2. 在实验室中制取少量乙酸乙酯的主要步骤如下:
① 把2毫升乙醇、1毫升浓硫酸装入反应的试管中,再加入2毫升10% 的醋酸。
② 在收集试管中,装入饱和的NaOH 溶液,组装好全部装置。
③ 将反应试管加强热,保持剧烈沸腾。
④ 倒出收集试管中的上层液体,即得到产品乙酸乙酯。
指出以上①—④步骤中的主要错误,并回答有关问题:
错误处:
① ________________________________________________________________________,
②________________________________________________________________________,
③________________________________________________________________________,
④________________________________________________________________________,
问题:
(1).步骤③操作的作用是(应小心加热,使酯化反应充分进行,并把乙酸乙酯蒸出)。
判断对错:( )
(2).收集试管中的导管为什么不能插入溶液中?
[答]:
(3).乙酸乙酯的主要用途是_________________,___________________。
3. 将自然界的矿物胆矾(CuSO4·5H2O)溶于水中,若遇到黄铁矿(FeS2),就会发生反应,生成辉铜矿(Cu2S)、硫酸亚铁和硫酸。在有些矿区见到的具有强酸性、强腐蚀性的地下水,俗称“黑水”,就是经过这种反应产生的。
14CuSO4 + 5Fe2S + 12H2O = 7Cu2S + 5FeSO4 + 12H2SO4.反应中,
被氧化的硫原子与被还原的硫原子的物质的量之比为( )。
|
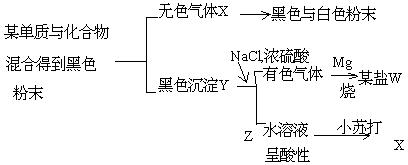
4. 根据下列图示,回答问题。 |
(1).原两种黑色粉末的名称是(碳)和(二氧化锰);
判断对错:( )
W 盐的化学式为( ALCL3 )。
判断对错:( )
(2). X 与Mg 的反应的化学方程式为: CO2 + 2Mg = 2MgO + C.
判断对错:( )
(3). Z 溶液呈酸性的主要原因是NaHSO4 = Na![]() + H
+ H![]() + SO
+ SO![]() .
.
判断对错: ( )
5. 在298K时,向V 升真空容器内通入N 摩SO2和M 摩H2S。
(1) 若N = 2 时,则当M 〉( )时,反应后容器内气体的密度最小。
(2) 若2N 〉M ,则反应后氧化产物与还原产物的质量差为( )克。
(3) 若5N = M ,且反应后氧化产物与还原产物的质量之和为48克,则N+M=( ).
6. 某液态有机物A6.2 克与足量镁粉反应,生成2.24 升H2(标准状态下),A与Na2CO3溶液不反应;在同温同压下测得A气体的密度为CO2气体密度的1.41倍。A分子内脱水可得B,A分子间脱水可得C或D。A氧化得E,E再氧化得F。A与F脱水可得G或H。
(1) 推断、写出结构简式:A______________C______________D_______________。
答:
(2) 写出A与F分子间脱水的化学方程式.
答:
|
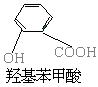
7. 化合物A,学名为邻羟基苯甲酸,俗名水杨酸,其结构简式如下图所示: (1) 将A跟哪种物质的溶液反应可得到一种钠盐, 其化学式为C7H5O3Na?( ) |
(A) NaOH (B) Na2S
(C) NaHCO3 (D) NaCL
(2)水杨酸的同分异构体中属于酚类,但是不属于酯类、也不属于羧酸类的化合物必定含
有_____基。 ( )
(A) 羟基 (B) 羧基
(C) 醛基 (D) 酚基
三、解答题:
有A、B两种溶液,A是把蒙有10.2克氧化铝的铝条放入1升1.5摩/升热NaOH溶液里,过会儿取出铝条,溶液增重12.6克。B是把蒙有氧化铝的铝条放入1升0.9摩/升的硫酸溶液,过会儿取出铝条,溶液增重25.2克。假设A、B两溶液最后的体积仍为1升。
回答下列问题:
A溶液中的溶质是什么?其物质的量的浓度是多少?
[答]:
参 考 答 案
一.
1. A 2. B 3. D 4. C 5. B 6. B 7. D 8. C
9. B 10. A 11. D 12. C 13. A 14. B 15. B 16. D
17. D 18. C 19. D 20. D 21. B 22. A 23. B 24.A
25. C
二、
1.
(1).对
(2). C
[分析]:其反应的化学方程式为:2NO + O2 = 2NO2
(3). B
(4). C
2.
[答]:
① 不应该先加入浓硫酸再加入醋酸;醋酸浓度太小。
② 导管不应该插入溶液中,这样会造成液体回吸。
③ 不应该加强热至剧烈沸腾。
④ 不应将产品直接倒出,使产品不纯。
(1). 对
(2).[答]:
因为由于乙酸乙酯液化,造成溶液回吸。
(3).
[答]:
(1) 作为溶剂 (2) 医药。
3. ( 3 :7 )
4.
(1).对;
错。
[答]: 正确的是MgCL2.
(2). 对
(3). 对
5.(1) ( 4 )
(2) ( 16 )
(3) ( 3 )
6.
(1)
|
答:A、C、D如图所示 |
(2)
答: HOCH2CH2OH + HOOCCOOH → HOCH2CH2OOCCOOH + H2O.
7.
(1)C
(2)C
三、
[答]: AL2O3 + 2NaOH = 2NaALO2 + H2O
102 2 摩 2 摩
10.2
消耗 NaOH 0.2 摩,生成NaALO2 0.2 摩
12.6 -10.2 = 2.4 (铝反应的增重)
2AL + 2NaOH +2H2O = 2NaALO2 + 3H2 增重
54克 2 摩 2 摩 6 克 54—6=48克
铝消耗 NaOH 为0.2+0.1=0.3,共生成NaALO2 0.3.
A 溶液中的溶质是NaALO2和NaOH,分别为0.3摩/升,1.3摩/升。