高三化学试卷 (3)
可能用到的原子量:
H 1 He 4 C 12 N 14 O 16 Na 23
Mg 24 Al 27 S 32 Cl 35.5 Zn 65
一. 选择题:
1. 工业上制取镁粉的方法是将镁的蒸气进行冷却,其中下列最适宜的方法是( )
(A) 在氮气的容器内冷却
(B) 在水中冷却
(C) 在氢气中冷却
(D) 在二氧化碳气体里冷却
2. 下列微粒的空间结构呈正四面体,但键角不是109 度28分的是( )
(A) 白磷P4 (B) 四氯化碳CCl4
(C) 铵根离子 NH![]() (D) 磷化氢PH3
(D) 磷化氢PH3
3. 下列八种工业生产,可直接用到石灰石的是( )
① 炼铁 ② 炼钢 ③ 制硅酸盐水泥 ④ 制普通玻璃
⑤ 制漂白粉 ⑥ 制电石 ⑦ 制波尔多液 ⑧ 制过磷酸钙肥料
(A) ①②③④ (B) ①③④⑥
(C) ①③④⑤ (D) ②③④⑧
4. 下列对熔、沸点变化规律叙述正确的是( )
(A) 同主族元素的单质,熔点都随原子序数的增加而升高。
(B) 卤化氢的沸点随 原子序数的增大而升高。
(C) 烷烃沸点随分子中的碳原子数增多而升高;当分子中碳原子相等时,支链越少,
其沸点越高。
(D) 低级饱和脂肪卤代烃的沸点随分子中碳原子数增多而降低。
5. 某物质只含一种元素,则此物质( )
(A) 一定是一种单质
(B) 一定是纯净物
(C) 一定是混和物
(D) 可能是纯净物,也可能是混和物
6. 将下列各组括号内的少量杂质除去的操作正确的是( )
(A) 福尔马林(甲酸):加Na2CO3 蒸馏
(B) 乙醇(水):加浓H2SO4 蒸馏
(C) O2(H2 、H2O):通过浓硫酸洗气,再通过灼热的CuO 粉末
(D) FeCl2溶液(FeCl3):加足量的铁粉,振荡、过滤
7. 同温、同压下同体积的A 、B 两种气体或蒸气的质量比为23:16,当B的分子量为32 时,
则A 的分子式不可能是( )
① C2H6O ② CH2O2 ③ 气态烷烃 ④ N2O
(A) ①、② (B) ①、③
(C) ②、③ (D) ③、④
8. 在Na2SO4与K2SO4的混和溶液中,当[Na![]() ]= 0.2摩/升, SO
]= 0.2摩/升, SO![]() = x 摩/升,
= x 摩/升,
K![]() = y 摩/升,则x 和y 的关系是( )
= y 摩/升,则x 和y 的关系是( )
① x = 0.1+0.5y ② x = 0.5y
③ y = 2x-0.1 ④ y = 2(x-0.1)
(A) ①、③ (B) ①、④
(C) ②、④ (D) ③、④
9. A 、B 、C 、D 、E是同周期五种主族元素。A 和B 的最高价氧化物对应的水化物均呈现碱性,且碱性B > A ;C 和D 的气态氢化物的水溶液均显酸性,且酸性C > D ;五种元素形成的简单离子中,E 离子半径最小。则它们的原子序数由小到大的顺序为( )
(A) B 、A 、E 、D 、C (B) B 、A 、D 、C 、E
(C) E 、C 、D 、B 、A (D) C 、D 、E 、A 、B
10. 将100 克60 ℃的KNO3饱和溶液冷却至20 ℃,除去析出的晶体后,再向滤液中加水制
成1 升溶液,则所得溶液的浓度是( )
( KNO3 溶解度: 60 ℃110克,25 ℃31.6克)
(A) 0. 518 摩/升 (B) 0.316 摩/升
(C) 0.298 摩/升 (D) 0.149 摩/升
11. 下列各组溶液,不加任何试剂,也不做焰色反应就能将其一一区别出来的是( )
① Na2SO4 、BaCl2 、K2CO3 、KNO3
② NaCl 、AgNO3 、Na2CO3 、CaCl2
③ CuSO4 、BaCl2 、NaOH、NaCl
④ Al2(SO4)3 、Na2CO3 、Ba(NO3)2 、H2SO4
(A) ①、③ (B) ①、④
(C) ②、④ (D) ③、④
12. 下列各表达式,错误的是( )
① 氯化钠水解:NaCL = OH![]() + H
+ H![]()
② 铜在硫蒸气中燃烧:2Cu + S =![]() Cu2S
Cu2S
③ 钢铁吸氧腐蚀时正极的反应:2H2O + O2 + 4e = 4OH![]()
④ 氢气燃烧的热化学方程式:H2(气) + ![]() (气) = H2O + 285千焦
(气) = H2O + 285千焦
(A) ①、③ (B) ①、④
(C) ②、④ (D) ③、④
13. 下列反应中,正反应肯定是放热反应的是( )
① H2S → H2 + S (气) 降低温度,颜色变浅
② 2NO2 → N2O4 升高温度,颜色加深
③ mA + nB → pC 升高温度,A 的转化率变小
④ 2A → 2B + C 降低温度,B 的平衡浓度变小
(A) ①、③ (B) ①、④
(C) ②、③ (D) ③、④
14. 把一定量的醇( Cn H2n+1 OH )分成两等份,其中一份完全燃烧需288 克氧气,另一份中
加入过量的金属钠,产生22.4 升氢气(标准状况下),则n 值为( )
(A) 1 (B) 2
(C) 3 (D) 4
15. 有a 、b 、c 、d 四种一元酸溶液,进行以下实验:
① 摩尔浓度相同的a 、c 溶液,分别加入甲基醇溶液后,a 溶液变为黄色,c 溶液无明显变化; ② b 、c 对应的钠盐溶液摩尔浓度相同时, b 的钠盐溶液的pH值小于c 的钠盐溶液的pH值; ③ a 酸与d 酸对应的钠盐 反应成d 酸和a 酸对应的钠盐。
由此确定四种酸的酸性由强到弱的顺序为( )
(A) a > c > d > b (B) b > c > a > d
(C) d > a > b > c (D) c > d > a > b
16. 某工厂排出的废水,经测定pH 小于5,并含有较多的 Cu![]() ,对农作物和人畜都有毒
,对农作物和人畜都有毒
害。若用化学方法除去其中的有害成分,最好加入( )
(A) 食盐和烧碱 (B) 生石灰和铁粉
(C) 胆矾和石灰水 (D) 苏打和硫酸
17. 用惰性电极电解MSO4溶液直至阴极上有0.327 克金属M 沉积为止。为中和电解所产生
的酸溶液,加入0.2 摩/升的KOH溶液50 毫升,则此金属的原子量是( )
(A) 32.7 (B) 56
(C) 65.4 (D) 108
18. 已知白磷P4 与CuSO4 溶液反应的化学方式程可以表示为
11P + 15CuSO4 + 24H2O = 5Cu3P + 6H3PO4 + 15H2SO4
则1 摩尔CuSO4能氧化白磷的物质的量为( )
(A) ![]() 摩 (B)
摩 (B) ![]() 摩
摩
(C) ![]() 摩 (D)
摩 (D) ![]() 摩
摩
19. 下列关于卤素单质及其化合物的叙述中,正确的是( )
① 随着原子序数增大,卤化氢(HX)分子中的化学链极性逐渐减弱
② 向含有卤离子(X![]() )的溶液中,滴加AgNO
)的溶液中,滴加AgNO![]() 溶液,均有颜色不同的卤化银沉淀析出。
溶液,均有颜色不同的卤化银沉淀析出。
③ ⅠA 族和ⅡA 族的金属卤化物(RX 和RX![]() )均是易溶于水的离子化合物。
)均是易溶于水的离子化合物。
④ 卤素单质(X![]() )与铜、铁反应,其生成物分别为CuX
)与铜、铁反应,其生成物分别为CuX![]() 和FeX
和FeX![]()
(A) ①、③ (B) ①、④
(C) ②、④ (D) ③、④
20. 为了除去混入CO![]() 中的少量 HCl、SO
中的少量 HCl、SO![]() 、O
、O![]() 和水蒸气,可以把混和气体依次通过的试剂
和水蒸气,可以把混和气体依次通过的试剂
是( )
(A) Na![]() CO
CO![]() 溶液 → 浓硫酸 → 灼热的Cu → 品红溶液
溶液 → 浓硫酸 → 灼热的Cu → 品红溶液
(B) 品红溶液 → NaHCO![]() 溶液 → 浓硫酸 → 灼热的Cu
溶液 → 浓硫酸 → 灼热的Cu
(C) NaHCO![]() 溶液 → 品红溶液 → 灼热的Cu → 无水CaCl
溶液 → 品红溶液 → 灼热的Cu → 无水CaCl![]()
(D) NaOH溶液 → 高锰酸钾溶液 → 固体P![]() O
O![]() → 灼热的铜
→ 灼热的铜
21. 将盛有HCl溶液和CuSO![]() 溶液的两个烧杯分别放在天平的两个托盘上,调至平衡,在盛
溶液的两个烧杯分别放在天平的两个托盘上,调至平衡,在盛
有足量盐酸的烧杯中加入4.2克的MgCO![]() ,为了使天平保持平衡,应向CuSO
,为了使天平保持平衡,应向CuSO![]() 溶液里加
溶液里加
入铁粉的质量是( )
(A) 2 克 (B) 2.2 克
(C) 2.3 克 (D) 4.2 克
22. 电解H![]() O和D
O和D![]() O的“混和物”时,若电路中转移了3.75 摩尔的电子时,两极共生成
O的“混和物”时,若电路中转移了3.75 摩尔的电子时,两极共生成
气体34.5 克,在所得气体中,H 和D 的原子个数比为( )
(A) 1 :4 (B) 4 :1
(C) 3 :1 (D) 1 :3
23. 1.0克镁和氧化合反应生成氧化镁1.64克,1.0克镁在空气中燃烧生成物质量小于1.64
克,其原因是( )
(A) 镁没有完全燃烧
(B) 氧化镁逸到空气中
(C) 除生成氧化镁外,还生成氮化镁
(D) 镁与空气中二氧化碳反应
24. 把KOH 和KHCO![]() 的混和物25.6克放在敞口容器内,经充分加热、灼烧后冷却,剩余固
的混和物25.6克放在敞口容器内,经充分加热、灼烧后冷却,剩余固
体为19.4克,则原混和物中KOH和KHCO![]() 的组成为( )
的组成为( )
(A) KOH 物质的量>KHCO![]() 物质的量
物质的量
(B) KOH 物质的量<KHCO![]() 物质的量
物质的量
(C) KOH 物质的量=KHCO![]() 物质的量
物质的量
(D) KOH 和KHCO![]() 以任意物质的量之比混和
以任意物质的量之比混和
|
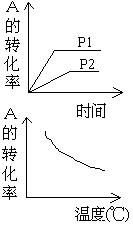
25. 图表示可逆反应 mA(气) + nB(气) ←→ xC(气) + Q 在不同温度、压强下,反应物A 转化率的变化情况。 下列对于反应热效应Q 和方程式中 A 、B 、C 的系 数的判断中, 正确的是( ) |
(A) Q > 0, m+n >x (B) Q >0, m+n <x
(C) Q < 0, m+n <x (D) Q <0, m+n >x
26. 蓄电池是一种可反复充电、放电的装置。它放电时起原电池的作
用,将化学能转变为电能;而充电时电解池的作用,将电能转变为化学能贮存起来。
某蓄电池充电和放电时发生的反应为:Fe + NiO2 + 2H2O→ Fe(OH)2 + Ni(OH)2
关于此蓄电池有下列说法:( )
①放电时,NiO![]() 为正极;②充电时,阳极反应式为:Fe(OH)
为正极;②充电时,阳极反应式为:Fe(OH)![]() +2e=Fe+2OH
+2e=Fe+2OH![]() ;
;
③放电时,电解质溶液中的阳离子向正极方向移动;
④充电时,Ni(OH) ![]() 的反应式为:Ni(OH)
的反应式为:Ni(OH) ![]() -2e=NiO
-2e=NiO![]() +2H
+2H![]() ;
;
⑤蓄电池的电极必须浸在碱性电解质溶液中;错误的是
(A) ③ (B) ② (C) ①③⑤ (D) ②和④
二、分析题与实验题:
|
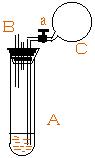
1. 如图所示,试管A内盛有2毫升饱和石灰水,试管上端连有胶头滴管 B,其中装有少量的NaOH 溶液;试管上端还连有一充满足量CO2的气球C, 气球与试管连接处有弹簧夹a夹紧。根据以下操作,填空: |
(1)将滴管B中的溶液逐渐滴入试管A中,
有无明显现象发生______________,
原因是_________________。
[答]:
(2)打开弹簧夹a将气球C中的气体,逐渐用力挤压至试管中,
所发生的现象是____________,发生反应的离子方程式为__________。
[答]
2. 实验室制备酚醛树脂的主要步骤如下:
(1) 在大试管中加入2.5 克苯酚和2.5 毫升40% 的甲醛溶液。
(2) 再加入1毫升浓盐酸,并把实验装置好。
(3) 将试管水浴加热至沸腾,反应不再剧烈进行,过一会儿便可停止加热。
(4) 取出试管中的粘稠固体,用水洗净得到产品。
填写下列空白:
(1) 在装置中,试管口加一带塞的直导管的作用是____________________________________.
(2) 加入浓盐酸的作用是_____________________,还可用_____________________代替盐酸.
3. 白磷固体的分子式为( ), 它的空间结构是正四面体。
白磷分子中共有键角( )个,键角是( )度.
4. (1). 蜂蜡也是一种酯,其分子式为:C56 H112 O2,它可由蜡酸C25H51COOH
与蜂醇酯化生成,此蜂醇的分子式为:C30H61OH .
请判断对错:( )
(2). 蜂蜡也是一种酯,其分子式为:C56 H112 O2,它可由蜡酸C25 H51 COOH
与蜂醇酯化生成,写出蜂蜡水解的化学方程式:
_____________________________________________________________。
三、在100 毫升FeCL2 溶液中通入一定量的CL2 气,然后在溶液中加入2 摩/升 NaOH 溶液125 毫升。充分反应后,将沉淀滤出,在滤液中加1.5 摩/升盐酸20 毫升,溶液恰好呈中性。把滤出的沉淀在空气中放置一段时间,放在坩埚中加热,最后得到的固体物质的质量为8 克,试求FeCL2 的摩尔浓度?
[解]:
参 考 答 案
一、
1. C 2. A 3. B 4. C 5. D 6. D 7. D
8. B 9. A 10. D 11. D 12. B 13. C 14. C
15. B 16. B 17. C 18. D 19. B 20. C 21. A
22. B 23. C 24. B 25. B 26. D
二、
1.(1)
[答]:出现白色的沉淀。 其原因是Ca(OH)2 微溶于水,存在着溶解平衡:Ca(OH)2→ Ca![]() + 2OH
+ 2OH![]() 当加入少量NaOH 溶液后,增大了OH
当加入少量NaOH 溶液后,增大了OH![]() 离子的浓度,使上述平衡向左移动,
离子的浓度,使上述平衡向左移动,
Ca(OH)2 出现沉淀。
(2)[答]: 白色沉淀开始增多,后又减少。
离子方程式: 2OH![]() + CO2 = CO
+ CO2 = CO![]() + H2O
+ H2O
Ca![]() + CO
+ CO![]() = CaCO3 ↓
= CaCO3 ↓
CaCO3 + H2O + CO2 = Ca![]() + 2HCO
+ 2HCO![]() .
.
2. (1) [答]:冷凝、回流防止甲醛和苯酚挥发。
(2) [答]:起催化作用。 可以用浓氨水来代替。
3. ( P4 )( 12 )( 60 )
4. (1). 对
(2). [答]: C56 H112 O2+H2O → C25 H51COOH+C30 H61OH
三、[解]:化学方程式为:
2FeCL2 → 2FeCL3 → 6NaOH → 2Fe(OH)3 → Fe2O3
与FeCL2 反应的NaOH 为 2×0.125-1.5×0.02=0.22 (摩尔)
则Fe2O3 质量为 0.5×0.073×160 = 5.84 (克),
说明CL2不足量,通入的CL2 使部分FeCL2 转化为FeCL3,溶液
中有FeCL2和FeCL3 。
设溶液中有FeCL2 X摩尔,FeCL3 Y摩尔,
FeCL2 + 2NaOH = Fe(OH)2↓ + 2NaCL
X 摩尔 X 摩尔
FeCL3 + 3NaOH = Fe(OH)3↓ + 3NaCL
Y 摩尔 Y 摩尔
得到: 2X + 3Y = 0.22
又因为: 4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
X 摩尔 X 摩尔
2Fe(OH)3 → Fe2O3 + 3H2O
(x+Y) 摩尔 0.5(X+Y) 摩尔
所以: 0.5(x+Y)× 160 = 8
解出: X = 0.08 摩尔 Y = 0.02 摩尔
原溶液中加FeCL2 的物质的量为:X+Y=0.1 摩尔
原FeCL2 溶液的摩尔浓度为:0.1 摩/升。