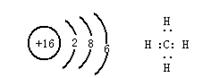高三级化学上册第三次检测考试
化 学 试 题
考试说明:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分;试卷总分100分。第Ⅰ卷答案涂在机读卡上,第Ⅱ卷答案写在答题卡上。
注意事项:1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目.试卷类型涂写在机读卡上。试卷类型应届生涂A, 往届生涂B.
2.每小题选出答案后,用铅笔把机读卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干
净后,再选涂其它答案,不能答在试题卷上。
3.考试结束, 机读卡和答题卡一并上交.。
4.可能用到的相对原子质量: H :1 C :12 O :16 ,S :32, Na:23 , Cl:35.5,Ag:108 Fe:56
第Ⅰ卷 选择题(共48分)
一、选择题:(每小题只有一个答案,每小题3分,共48分)
1、“嫦娥一号”探月卫星已于今年十月二十四日腾空而起,直奔月球。据科学家预测,月球的土壤中吸附着数百万吨的![]() ,每百吨
,每百吨![]() 核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以![]() 的形式存在。下列说法正确的是
的形式存在。下列说法正确的是
A ![]() 原子核内含有4个质子 B
原子核内含有4个质子 B ![]() 和
和![]() 互为同位素
互为同位素
C ![]() 原子核内含有3个中子 D
原子核内含有3个中子 D ![]() 的最外层电子数为2,所以
的最外层电子数为2,所以![]() 具有较强的金属性
具有较强的金属性
2、氯气是一种重要的工业原料。工业上利用反应3Cl2 + 2NH3 = N2 + 6HCl检查氯气管道是否漏气。下列说法错误的是
A、若管道漏气遇氨就会产生白烟; B、该反应利用了Cl2的强氧化性
C、该反应属于复分解反应; D、生成1molN2有6mol电子转移
3.已知1.2 g C(石墨)不完全燃烧生成CO,放出11.1 kJ热量,继续燃烧又放出28.3 kJ热量。则能表示C(石墨)燃烧热的热化学方程式为( )
A.C(石墨 s)+1/2O2(g)=CO(g);△H=-11.1kJ·mol-1
B.C(石墨 s)+1/2O2(g)=CO(g);△H=-111kJ·mol-1
C.C(石墨 s)+O2(g)=CO2(g);△H=-394kJ·mol-1
D.C(石墨 s)+O2(g)=CO2(g);△H=-283kJ·mol-1
4、(应届)25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是
A.c(NH4+)<c(SO42-) B.c(NH4+)>c(SO42-)
C.2c(NH4+)=c(SO42-) D.c(OH-)+c(SO42-) = c(NH4+)+c(H+)
4.(往届)瑞典皇家科学院诺贝尔奖评委会10日宣布,德国科学家格哈德·埃特尔因为在表面化学研究领域作出开拓性贡献而获得2007年诺贝尔化学奖。格哈德·埃特尔研究的内容能够帮助我们理解铁为什么会生锈、燃料电池如何工作、汽车里的催化剂如何工作。则下列相关说法正确的是
A.含碳生铁在发生电化学腐蚀的时候铁一般做正极
B.在氨的合成反应中,采用高温有利于氨生成
C.工业制硫酸的接触室中热交换器其主要作用:一方面使即将参加反应的气体达到一定温度,另一方面降低SO3的温度
D.SO2氧化为SO3时需使用V2O5催化剂,这样可以提高SO2的转化率
![]() 5.一定条件,反应CO2(g)
+ C (s)
2CO(g);△H>0达到平衡状态。下列说法正确的是
5.一定条件,反应CO2(g)
+ C (s)
2CO(g);△H>0达到平衡状态。下列说法正确的是
A.平衡混合气中,CO物质的量浓度一定是CO2物质的量浓度的2倍
B.若升高温度,CO2的转化率增大
C.若增大CO2的浓度,△H增大
D.若增大压强,平衡不移动
6.(应届)下列晶体熔化时化学键没有被破坏的是 ( )
A.食盐 B.冰醋酸 C.金刚石 D.水晶
6.(往届)短周期元素A、B、C原子序数依次增大,A、C同主族,B原子的最外层电子数等于A原子最外层电子数的一半,且三种元素原子的最外层电子数之和为15。下列叙述不正确的是
A.常温下B单质能与A单质反应 B.工业上采用热还原法冶炼B单质
C.A的氢化物沸点高于C的氢化物
D.B的氧化物既能溶于强酸溶液亦能溶于强碱溶液
7.下列有关比较中,大小顺序不正确的是
A.热稳定性: PH3 > H 2S > HCl > NH3 B.物质的熔点:石英>食盐>碘>汞
C.结合 H十的能力:![]()
D.分散系中分散质粒子的直径:Fe ( OH )3悬浊液> Fe ( OH ) 3 胶体> FeC13溶液
8、(应届)甲酸的下列性质中,可以证明它是弱电解质的是
A、1mol/L甲酸溶液的pH值约为2 B、甲酸能与水以任何比例互溶
C、10mL 1mol/L甲酸恰好与10mL 1mol/L NaOH溶液完全反应
D、甲酸溶液的导电性比硫酸溶液的弱
8、(往届)下列物质的提纯方法或说法正确的是
A、以精铜为阳极,粗铜为阴极,CuSO4溶液为电解液精炼铜
B.纯锌与稀H2SO4反应滴入少量的CuSO4溶液后反应速率加快
C、除去KCl溶液中的少量MgCl2,加入过量KOH溶液,然后过滤即可
D、加入澄清的石灰水,能产生白色沉淀,则原溶液中一定含有CO![]()
9、下列叙述正确的是
A、48gO3气体约含有6.02×1023个O3分子 B、5.6g Fe与足量的稀盐酸反应发生电子0.3 mol
C、1L0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D.常温常压下28 g CO与22.4 L O2所含分子数相等
10.下列说法正确的是
A.将pH试纸浸在溶液中,观察其颜色变化,跟标准比色卡比较
B.利用丁达尔效应可以区别溶液与胶体 C.构成分子晶体的粒子中一定含有共价键
D.用盐酸滴定NaOH溶液的实验中,锥形瓶用水洗后,再用NaOH冲洗2 ~ 3次
11、(应届) 25℃时,水的电离达到平衡:H2O![]() H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A、 向水中加入稀氨水,平衡逆向移动,c(OH―)降低
B、 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C、 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D、 将水加热,Kw增大,pH不变
11.(往届)碳跟浓硫酸共热产生的气体通入下列溶液中,产生的现象正确的是
A 通入氯化钙溶液中产生白色沉淀 B 通入硝酸钡溶液中产生白色沉淀
C 通入酸性高锰酸钾溶液中无颜色变化
D 通入足量的澄清石灰水中只产生碳酸钙白色沉淀
12、(应届)下列各组离子中,在无色透明的酸性溶液中,可以大量共存的是
A.Al![]() 、Na
、Na![]() 、SO
、SO![]() 、Br
、Br![]() B.Na
B.Na![]() 、NH
、NH![]() 、NO
、NO![]() 、I
、I![]()
C.K![]() 、Mg
、Mg![]() 、Fe
、Fe![]() 、Cl
、Cl![]() D.Na
D.Na![]() 、AlO
、AlO![]() 、SO
、SO![]() 、CO
、CO![]()
12、(往届)氢氧燃料电池以H2为还原剂,O2为氧化剂,电极为多孔镍,电解质溶液为30%的KOH溶液,以下叙述正确的是
①放电一段时间后,电解质溶液中KOH的物质的量将改变
②负极反应为:2H2+4OH——4e— = 4H2O
③工作时正极区pH升高,而负极区pH降低 ④工作时阴离子移向正极
A、①③④ B、②③ C、②④ D、①④
13、下列化学反应的离子方程式正确的是
A、用小苏打治疗胃酸过多: HCO3- + H+ == CO2↑+ H2O
B、往碳酸镁中滴加稀盐酸: CO32- + 2H+ == CO2↑+ H2O
C.醋酸钠的水解的反应:CH3COO—+H3O+=CH3COOH+H2O
D、氢氧化钡溶液与稀硫酸反应: Ba2+ + SO42- + H+ + OH- == BaSO4↓+ H2O
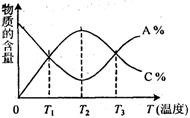
![]() 14.已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
14.已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
A.该反应在T1、T3温度时达到过化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
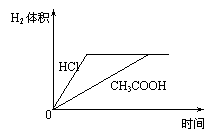 15.对室温下100mLpH=2的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
15.对室温下100mLpH=2的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
A.加水稀释至溶液体积为200mL,醋酸溶液的pH变为4
B.温度都升高20℃后,两溶液的pH不再相等
C.加水稀释至溶液体积为200mL后,两种溶液的c(OH—)都减小
D.加足量的锌充分反应后,两溶液中产生的氢气体积可用下图表示
16. 在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,
溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。
下列判断不正确的是
A.氧化性:ClO –>I2>SO42–
B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.向氯水中加入亚硫酸钠溶液,氯水褪色
D.次氯酸钠可以与亚硫酸钠共存
|
二、填空题:(18分)
17.(6分)常温下有浓度均为0.5mol·L-1的四种溶液:①碳酸钠溶液 ②碳酸氢钠溶液 ③盐酸 ④氨水。请根据题目要求回答下列问题:
(1)上述溶液中,可发生水解反应的是 (填序号,下同),在发生水解反应的溶液中pH最大的是 。
(2)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是 。
(3)取适量溶液④,加入少量氯化铵固体,此时溶液中![]() 的值 (填“增大”
的值 (填“增大”
或“减小”或“不变”)
(4)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是
。
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)= 。
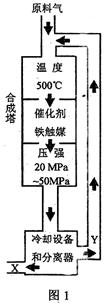
18.(12分)(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意如
|
①X分子的空间结构为 ;
②图1中条件选定的主要原因是(选填字母序号) ;
A.温度、压强对化学平衡影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
|
③改变反应条件,会使平衡发生移动。如图2表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号) ,当横坐标为温度时,变化趋势正确的是(选填字母序号) 。
(2)常温下氨气极易溶于水,其水溶液可以导电。 ①用化学方程式表示氨气溶于水的过程中存在的可逆反应 ;
②常温时,氨水中由水电离出的c(H+)·c(OH—) 10—14(填写“>”、“<”或“=”);
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3mol A。
①写出氨气和氟气反应的化学方程式 ;
②在标准状况下,每生成1mol B,转移电子的物质的量为 mol。
三.推断题(12分) 19.(12分)A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比2:3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1)Z的原子结构示意图为 ;化合物BA4的电子式为 。
(2)化合物Y2X2中含有的化学键类型有 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)化合物A2X和A2Z中,沸点较高的是 (填经学式),其主要原因是 。
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为 。
(5)常温常压下,由A、B、X可组成的液态物质甲。现有2.3g甲与足量的X的单质充分反应,生成标准状况下2.24L的BX2气体和2.7g的A2X液体,同时放出68.35kJ的热量,该反应的热化学方程式为 。
四、实验题:(12分) 20、(12分)(应届)准确移取25.00mL某未知浓度的盐酸溶液于一洁净锥形瓶中,然后用0.20mol/L NaOH溶液滴定(指示剂为酚酞)。滴定结果如下:
| NaOH溶液起始读数 | NaOH溶液终点读数 | |
| 第一次 | 0.01mL | 18.60mL |
| 第二次 | 0.20mL | 18.70mL |
(1)根据以上数据可计算出盐酸的物质的量浓度为 mol/L。(精确到0.01)
(2)如标准NaOH溶液由于保存不妥而变质(和空气中CO2反应产生少量Na2CO3)测出的盐酸浓度
(填“偏高”、“偏低”或不变”)。
(3)若操作有误,则导致待测盐酸溶液浓度偏低的错误操作是 (填序号)。
A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液
B.滴定前滴定管尖端有气泡,滴后气泡消失 C.滴定管读数时,滴定前仰视滴定后俯视
D.待测液中指示剂酚酞(为有机弱酸)加得太多
(4)如果准确移取25.00mL 0.20mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度? (填 “是”或“否”)
 20、(12分)(往届)已知A、B、D、E四种物质中含有同一种短周期元素,D为气体单质,E为黑色粉末,在右图的转化中E均起催化作用(某些产物已略去)。
20、(12分)(往届)已知A、B、D、E四种物质中含有同一种短周期元素,D为气体单质,E为黑色粉末,在右图的转化中E均起催化作用(某些产物已略去)。
请回答:
(1)A的化学式: ;
B分子的电子式: 。
(2)已知E与含A中某元素的酸在一定条件下反应,产生一种含该元素的气体X。
我校某班化学兴趣小组为研究该气体的性质,设计下图所示的装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
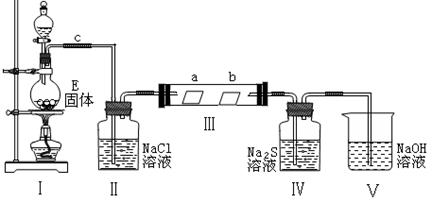 |
①写出装置Ⅰ中发生反应的离子方程式: 。
②实验过程中,观察到装置Ⅳ中出现淡黄色沉淀,其主要反应的离子方程式: 。
③实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是a出现了明显的变化。你认为在装置(选填装置序号) 之间,还需添加洗气瓶,该装置的作用是: 。
(3)气体X能与溶液B反应,生成气体D,写出反应的化学方程式: 。
五、计算题:(10分)
21.(应届)在1 L密闭容器中,把1 mol A和1 mol B混合发生如下反应:
3A(g)+B(g)![]() xC(g)+2D(g),当反应达到平衡时,生成0.4
mol D,并测得C的平衡浓度为0.4 mol/L,通过计算完成下列问题:
xC(g)+2D(g),当反应达到平衡时,生成0.4
mol D,并测得C的平衡浓度为0.4 mol/L,通过计算完成下列问题:
(1)在该平衡下,在保持压强不变时,向该容器内充入氦气,则该平衡向 (填写“正向移动”、“逆向移动”、“不移动”)
(2)x的值为 ; (3)平衡时A的转化率为 ;
(4)如果加入0.2mol的C、 0.2molD、0.9molB和0.7molA充入到原来容器内,保持原来的条件不变,则达到平衡时B的物质的量浓度是 。
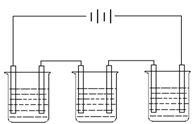 |
21、(往届)下图为相互串联的甲、乙、丙三电解池,试回答:
(1)若甲池利用电解原理在铁上镀银,则B是
|
应选用的电解质溶液是 。
(2)乙池中若滴入少量酚酞试液,开始电解一段
|
(3)若甲槽阴极增重4.32g,乙槽中剩余溶液仍为
400mL ,则电解后所得溶液的pH值等于 。
(4)若丙为用石墨电极电解100mLH2SO4和CuSO4混合溶液,通电一段时间后,两极各出现气体2.24L(标准状况),求原来溶液中CuSO4的物质的量浓度为____________。
![]()
![]() 甘谷一中高三级第三次检测考试
甘谷一中高三级第三次检测考试
| 试卷 类型 | A | |
| B |
化学试卷答题卡
考生注意:试卷类型应届生选A, 往届生选B.在相应字母后打“√”。
第Ⅱ卷(52分) 座位号:
| 题 号 | 二 | 三 | 四 | 五 | 第Ⅱ卷总分 |
| 得 分 |
|
|
|
|
|
二、填空题:(18分)
17.(6分)(1)上述溶液中,可发生水解反应的是 (填序号,下同),
在发生水解反应的溶液中pH最大的是 。
(2)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是 。
(3)取适量溶液④,加入少量氯化铵固体,此时溶液中![]() 的值 (填“增大”或“减小”或“不变”)
的值 (填“增大”或“减小”或“不变”)
(4)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是
。
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)= 。
18.(12分)①X分子的空间结构为 ;
②图1中条件选定的主要原因是(选填字母序号) ;
③当横坐标为压强时,变化趋势正确的是(选填字母序号) ,当横坐标为温度时,变化趋势正确的是(选填字母序号) 。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用化学方程式表示氨气溶于水的过程中存在的可逆反应
;
②常温时,氨水中由水电离出的c(H+)·c(OH—) 10—14(填写“>”、“<”或“=”);
(3)①写出氨气和氟气反应的化学方程式 ;
②在标准状况下,每生成1mol B,转移电子的物质的量为 mol。
三.推断题(12分)
19.(12分)(1)Z的原子结构示意图为 ;化合物BA4的电子式为 。
(2)化合物Y2X2中含有的化学键类型有 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)化合物A2X和A2Z中,沸点较高的是 (填经学式),其主要原因是 。
(4)此两种化合物发生反应的化学方程式为 。
(5) 。
四、实验题:(12分)
20、(12分)(应届)
(1)根据以上数据可计算出盐酸的物质的量浓度为 mol/L。(精确到0.01)
(2)如标准NaOH溶液由于保存不妥而变质(和空气中CO2反应产生少量Na2CO3测出的盐酸浓度
(填“偏高”、“偏低”或不变”)。
(3)若操作有误,则导致待测盐酸溶液浓度偏低的错误操作是 (填序号)。
A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液
B.滴定前滴定管尖端有气泡,滴后气泡消失 C.滴定管读数时,滴定前仰视滴定后俯视
D.待测液中指示剂酚酞(为有机弱酸)加得太多
(4)如果准确移取25.00mL 0.20mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度? 填 (“是”或“否”)
20、(12分)(往届)
(1)A的化学式: ;
B分子的电子式: 。
(2)①写出装置Ⅰ中发生反应的离子方程式: 。
②观察到装置Ⅳ中出现淡黄色沉淀,其主要反应的离子方程式: 。
③你认为在装置(选填装置序号) 之间,还需添加洗气瓶,该装置的作用是: 。
(3)气体X能与溶液B反应,生成气体D,写出反应的化学方程式: 。
五、计算题:(10分)
21.(应届)(1)则该平衡向 (填写“正向移动”、“逆向移动”、“不移动”)
(2)x的值为 ;
(3)平衡时A的转化率为 ;
(4)如果加入0.2mol的C、 0.2molD、0.9molB和0.7molA充入到原来容器内,保持原来的条件不变,则达到平衡时B的物质的量浓度是 。
21、(往届)(1)若甲池利用电解原理在铁上镀银,则B是 、 (填电极材料和电极名称), 应选用的电解质溶液是 。
(2)乙池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈 色,C极附近呈 色。
(3)若甲槽阴极增重4.32g,乙槽中剩余溶液仍为400mL ,则电解后所得溶液的pH值等于 。
(4)若丙为用石墨电极电解100mLH2SO4和CuSO4混合溶液,通电一段时间后,两极各出现气体2.24L(标准状况),求原来溶液中CuSO4的物质的量浓度为____________。
参考答案
第I卷 选择题(48分)
一、选择题: 1. B 2.C 3.C 4.(应届)B 4.(往届)C 5.B 6.(应届)B 6.(往届)B 7.A 8.(应届)A 8. (往届)B 9.A 10.B 11. (应届)B 11. (往届) B 12. (应届)A
12. (往届) B 13. A 14.B 15.B 16.D
|
二、填空题:(18分)
17.(共6分,每空1分)(1)①② ① (2)② (3)减小
(4)c(C1-)>c(NH4+)>c(H+)>c(OH-) (5)10-12mol·L-1
18.(12分)(1)①三角锥形(1分) ②BC(2分,只选1个且正确给1分,错选、多选不给分)
③c;a(各1分,共2分)
|
(3)①4NH3+3F2 NF3+3NH4F(催化剂要注明)(2分) ②6(2分)
三.推断题(12分)
|
(1)
(2)A、C (3)H2O 水分子间存在氢键(2分)
(4)4H2O2+H2S=H2SO4+4H2O或H2O2+H2S=S↓+2H2O(写成H2SO3不得分)
(5)C2H6O(1)+3O2(g)=2CO2(g)+3H2O(1);△H=-1367kJ·mol-1(2分)
四、实验题(12分) 20、(12分)(应届)
(1)0.15(2)不变(3)C(4)是![]()
![]() 20.(12分)(往届)(1)A为KClO3 B的电子式为
(每空1分)
20.(12分)(往届)(1)A为KClO3 B的电子式为
(每空1分)
(2)①MnO2 + 4H+ + 2Cl- Mn2+ + Cl2↑ + 2H2O
(2分,不写条件和气体符号得1分)
②S2- + Cl2 === 2Cl- + S↓ (2分,不写沉淀符号只得1分)
③Ⅱ、Ⅲ 除去氯气中的水蒸气(或干燥氯气) (每空2分)
(3)Cl2 + H2O2 === 2HCl + O2 (2分)
五、计算题(10分)
21.(应届)(1)不移动(2分) (2)x=2, (3分) (3)60%(3分)(4)0.8mol/L(2分)
21、(往届)(10分)
(1) B: 阳极,Ag AgNO3溶液
(2) 红色 ; 无色
(3) 13 (4) 1mol/L