高三理科综合统一练习卷二
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。满分300分。考试时间150分钟。
第I卷 (选择题 共120分)
本试卷共20小题,每小题6分,共120分,在每小题列出的四个选项中,选出符合题目要求的一项。
以下数据可供解题时参考:
可能用到的相对原子质量: H-1 O-16 C-12 Cl-35.5 Ag-108
Fe-56
1. 下列关于实验的描述,正确的是
A. 用纤维素酶处理B淋巴细胞与小鼠骨髓瘤细胞以形成杂交瘤细胞
B. 将双缩脲试剂A加入到蛋清稀释液中摇匀,再滴入双缩脲试剂B摇匀,溶液变成紫色
C. 将肝脏研磨液煮沸冷却后,加入到过氧化氢溶液中立即产生大量气泡
D. 将斐林试剂加入到蔗糖溶液中,加热后出现砖红色沉淀
2. 运动饮料是根据运动时能量消耗、机体内环境改变等生理特点而配制的特殊饮料。根据所学知识判断下列最适合作为运动员剧烈运动后饮用的是
A. 含蛋白质、微量电解质,高渗透压的饮料
B. 含蛋白质、维生素、适量电解质,低渗透压的饮料
C. 含葡萄糖、适量电解质、维生素,低渗透压的饮料
D. 含葡萄糖、氨基酸、维生素,高渗透压的饮料
3. 下图表示某绿色植物的非绿色器官在氧浓度为a、b、c、d时,CO2释放量和O2吸收量的变化。下列相关叙述正确的是
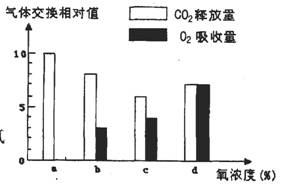
A. 氧浓度为a时,最适于贮藏该植物器官
B. 氧浓度为b时,无氧呼吸消耗的葡萄糖是有氧呼吸的5倍
C. 氧浓度为c时,无氧呼吸最弱
D. 氧浓度为d时,无氧呼吸的强度与有氧呼吸相等
4. 下列有关种群的叙述正确的是
A. 种群是指一个生态系统中同种生物所有成熟个体的总和
B. 合理密植农作物时,其数量可以大于最大值即K值
C. 种群中各年龄期的个体数目比例大致相同,这样的种群正处于发展阶段
D. “S”型增长种群中,种群数量为K/2时增长速率最大
5. 生产、生活中的问题常涉及到化学知识,下列叙述中不正确的是
A. 用汽油、煤油除去油污时发生的主要是物理变化
B. 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应
C. 在含硫的燃料中加入适量生石灰,以减少二氧化硫的排放量
D. 棉花、蚕丝和人造丝的主要成分是纤维素
6. 下列叙述中正确的是
A. 二氧化硅晶体和干冰晶体熔化时所克服的作用力类型相同
B. 分子晶体中一定含有共价键,离子晶体中一定含有离子键
C. 离子晶体都是强电解质
D. 检验淀粉是否已经全部水解时,可取少量样品,向其中加入银氨溶液,水浴加热,若能发生银镜反应说明淀粉已经全部水解
7. 有下列三个反应:①![]()
②2![]()
③![]() 下列说法正确的是
下列说法正确的是
A. ①②③中的氧化产物分别是![]()
B. 根据以上方程式可以得到氧化性![]()
C. 可以推理得到![]()
D. 在③反应中当![]() 参加反应时,有
参加反应时,有![]() 被氧化
被氧化
8. 在下列条件下一定能大量共存的离子组是
A. 在![]() 的溶液中:
的溶液中:![]()
B. 在pH=1的溶液中:![]()
C. 在能使紫色的石蕊试液变红的溶液中:![]()
D. 在加入铝单质能产生大量氢气的溶液中:![]()
9. 下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是
①碳酸钠溶液与盐酸 ②偏铝酸钠溶液与盐酸 ③苯酚钠溶液与CO2
④硝酸银溶液与氨水 ⑤氯化铝溶液与氨水 ⑥碳酸氢钠溶液与澄清的石灰水
A. ③⑤ B. ①③⑥ C. 仅有⑤ D. ②④
10. 关于下列各装置图的叙述中,不正确的是
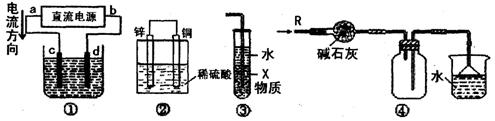
A. 若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
B. 装置②是原电池,能将化学能转化为电能,锌电极发生氧化反应
C. 装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D. 装置④可用于干燥、收集氨气,并吸收多余的氨气
11. 下列说法正确的是
A. 只有非金属能形成含氧酸和含氧酸盐
B. VIA族元素的氢化物中稳定性最好的,其沸点也最高
C. 同一主族的元素,原子半径越大其单质的熔点越高
D. 除稀有气体外的非金属元素,都能形成不同价态的含氧酸
12. 下列说法正确的是
A. 若酸性![]() ,则相同条件下,溶液的pH大小为
,则相同条件下,溶液的pH大小为![]()
B. 相同条件下,将pH=11的NaOH溶液和氨水分别稀释成pH=9的溶液,所加水的体积前者大
C. pH=3的醋酸与pH=11的NaOH溶液等体积混合时,溶液中离子浓度的大小顺序是![]()
D. ![]() 的某二元弱酸盐
的某二元弱酸盐![]() 溶液中,
溶液中,![]()
13. 根据热力学定律和分子动理论,可知下列说法正确的是
A. 布朗运动是液体分子的无规则运动,它说明分子永不停息地做无规则运动
B. 我们可以利用高科技手段,将流散到周围环境中的内能重新收集起来加以利用而不引起其他变化
C. 当分子间的距离增大时,分子间的引力增大,斥力减小,所以分子间作用力表现为引力
D. 不可能从单一热源吸收热量并把它全部用来做功而不引起其他变化
14. 某核反应方程为![]() 。已知
。已知![]() 的质量为
的质量为![]() 的质量为
的质量为![]() ,
,![]() 的质量为4.0026u,X的质量为
的质量为4.0026u,X的质量为![]() 。则下列说法中正确的是
。则下列说法中正确的是
A. X是中子,该反应释放能量
B. X是质子,该反应释放能量
C. X是中子,该反应吸收能量
D. X是质子,该反应吸收能量
15. 在高为h的平台上,以速度v0水平抛出一石子,不计空气阻力,则石子从抛出到落地经过的时间
A. 只与v0有关,v0越大,时间越长
B. 只与h有关,h越大,时间越长
C. 与v0、h都有关
D. 与v0、h都无关
16. 一列沿x轴正向传播的横波在某时刻的波形图如图甲所示。a、b、c、d为介质中沿波的传播方向上四个质点的平衡位置,若从该时刻开始计时,则图乙是下面哪个质点经过![]() 个周期后的振动图象
个周期后的振动图象
A. a处质点 B. b处质点 C. c处质点 D. d处质点
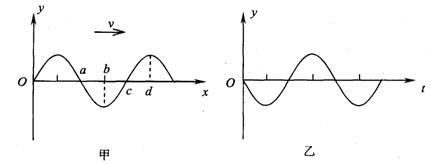
17. 如图所示,有一等腰直角三棱镜ABC,它对各种色光的临界角都小于45°。一束平行于BC面的白光射到AB面上,进入三棱镜后射到BC面上,则光束
A. 各色光从BC面上不同点射出
B. 各色光从BC面上同一点射出
C. 各色光从AC面上不同点射出
D. 各色光从AC面上同一点射出
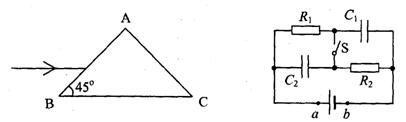
18. 在如图所示的电路中,电源两端a、b间的电压恒定不变。开始时S断开,电容器上充有电荷。闭合S后,以下判断正确的是
A. C1所带电量增大,C2所带电量减小
B. C1所带电量减小,C2所带电量增大
C. C1、C2所带电量均增大
D. C1、C2所带电量均减小
19. 如图所示,理想变压器初级线圈的匝数为n1,次级线圈的匝数为n2,初级线圈两端a、b接正弦交流电源,电压表V的示数为220V,负载电阻R=44![]() 时,电流表A1的示数为0.20A。初级和次级线圈的匝数比为
时,电流表A1的示数为0.20A。初级和次级线圈的匝数比为
A. 1:5 B. 5:1 C. 1:10 D. 10:1
20. 如图所示,质量为m的物块甲以3m/s的速度在光滑水平面上运动,有一轻弹簧固定其上,另一质量也为m的物块乙以4m/s的速度与甲相向运动。则
A. 甲、乙两物块在弹簧压缩过程中,由于弹力作用,甲、乙(包括弹簧)构成的系统动量不守恒
B. 当两物块相距最近时,甲物块的速率为零
C. 当甲物块的速率为1m/s时,乙物块的速率可能为2m/s,也可能为0
D. 甲物块的速率可能达到5m/s
第II卷 (非选择题 共180分)
本卷共11小题,共180分。
21. (18分)
(1)有一游标卡尺,主尺的最小分度是1mm,游标上有20个小的等分刻度。用它测量一小球的直径,如图1所示的读数是__________mm。
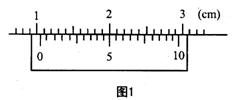
用螺旋测微器测量一根金属丝的直径,如图2所示的读数是_________mm。
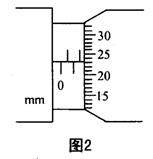
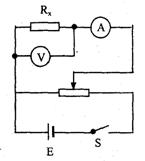
(2)某同学在实验室测汽车电热器Rx的电功率,此电热器额定电压为12V(车用蓄电池输出的最高直流电压)。该同学用学生电源代替蓄电池,输出电压为16V,导线、开关等已经备齐,供选择的器材还有:
A. 电流表(0~3A,0.l![]() )
)
B. 电流表(0~0.6A,10![]() )
)
C. 电压表(0~3V,1k![]() )
)
D. 电压表(0~15V,30k![]() )
)
E. 滑动变阻器(0~10![]() ,0.5A)
,0.5A)
F. 滑动变阻器(0~10![]() ,2A)
,2A)
该同学测量的数据记录如下
| U/V | 2.2 | 3.0 | 5.0 | 8.0 | 10.0 | 12.0 |
| I/A | 0.15 | 0.20 | 0.30 | 0.40 | 0.45 | 0.50 |
①合理选择使用的器材:电流表选_________,电压表选__________,滑动变阻器选_____________。(填写序号字母)
②在图甲的方框中画出合理的电路图。
③在图乙的坐标纸上作出U-I图象。
④电热器的额定功率为____________W。
22. (l6分)某些城市交通部门规定汽车在市区某些街道行驶速度不得超过vm=30km/h。一辆汽车在该水平路段紧急刹车时车轮抱死,沿直线滑行一段距离后停止,交警测得车轮在地面上滑行的轨迹长sm=10m。从手册中查出该车车轮与地面间的动摩擦因数![]() 0.72,取g=10m/s2。
0.72,取g=10m/s2。
(l)请你通过计算判断汽车是否超速行驶;
(2)目前,有一种先进的汽车制动装置,可保证车轮在制动时不被抱死,使车轮仍有一定的滚动。安装了这种防抱死装置的汽车,在紧急刹车时可获得比车轮抱死更大的制动力,从而使刹车距离大大减小。假设汽车安装防抱死装置后刹车制动力恒为F,驾驶员的反应时间为t,汽车的质量为m,汽车刹车前匀速行驶的速度为v,试推出驾驶员发现情况后,紧急刹车时的安全距离s的表达式。
23. (l8分)如图所示,BC是半径为R的![]() 圆弧形的光滑且绝缘的轨道,位于竖直平面内, 其下端与水平绝缘轨道平滑连接,整个轨道处在水平向左的匀强电场中,电场强度为 E. 现有一质量为m、带正电q的小滑块(可视为质点),从C点由静止释放,滑到水平轨道上的A点时速度减为零。若已知滑块与水平轨道间的动摩擦因数为
圆弧形的光滑且绝缘的轨道,位于竖直平面内, 其下端与水平绝缘轨道平滑连接,整个轨道处在水平向左的匀强电场中,电场强度为 E. 现有一质量为m、带正电q的小滑块(可视为质点),从C点由静止释放,滑到水平轨道上的A点时速度减为零。若已知滑块与水平轨道间的动摩擦因数为![]() ,求:
,求:
(1)滑块通过B点时的速度大小;
(2)滑块经过圆弧轨道的B点时,所受轨道支持力的大小;
(3)水平轨道上A、B两点之间的距离。
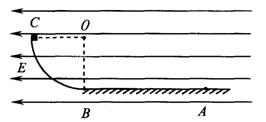
24. (20分)如图甲所示,光滑且足够长的平行金属导轨MN、PQ固定在同一水平面上,两导轨间距L=0.3m。导轨电阻忽略不计,其间连接有固定电阻R=0.4![]() 。导轨上停放一质量m=0.1kg、电阻r=0.2
。导轨上停放一质量m=0.1kg、电阻r=0.2![]() 的金属杆ab,整个装置处于磁感应强度B=0.5T的匀强磁场中,磁场方向竖直向下。利用一外力F沿水平方向拉金属杆ab,使之由静止开始运动,电压传感器可将R两端的电压U即时采集并输入电脑,获得电压U随时间t变化的关系如图乙所示。
的金属杆ab,整个装置处于磁感应强度B=0.5T的匀强磁场中,磁场方向竖直向下。利用一外力F沿水平方向拉金属杆ab,使之由静止开始运动,电压传感器可将R两端的电压U即时采集并输入电脑,获得电压U随时间t变化的关系如图乙所示。
(l)试证明金属杆做匀加速直线运动,并计算加速度的大小;
(2)求第2s末外力F的瞬时功率;
(3)如果水平外力从静止开始拉动杆2s所做的功为0.3J,求回路中定值电阻R上产生的焦耳热是多少。
25. (16分)咖啡酸(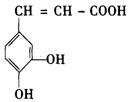 )也叫3,4—二羟基桂皮酸,它存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效。
)也叫3,4—二羟基桂皮酸,它存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效。
(1)咖啡酸的分子式是____________________。
(2)咖啡酸不具有以下哪些化学性质__________(填写序号字母)。
A. 有浓硫酸、加热条件下能发生消去反应
B. 能与FeCl3溶液发生显色反应
C. 能发生银镜反应
D. 一定条件下能发生酯化反应
(3)1mol咖啡酸跟浓溴水反应时最多消耗______molBr2,反应类型有
____________________________________________________________。
(4)写出咖啡酸一定条件下发生加聚反应的方程式
____________________________________________________________。
写出咖啡酸与NaHCO3溶液反应的方程式
____________________________________________________________。
(5)写出符合下列条件的有机物A的结构简式
有机物A的分子式为C9H10O2;分子中有一个甲基;A能发生水解反应;在溶液中1molA能与2molNaOH反应
____________________________________________________________。
(6)将一定量咖啡酸与A的混合物点燃。该混合物完全燃烧消耗x L O2,并生成yg H2O和mL CO2(气体体积均为标准状况下的体积)。列出混合物中咖啡酸的物质的量的计算式____________________。
26. (18分)现有一份含有FeCl3和FeCl2固体的混合物,为测定各成分的含量进行如下两个实验:
实验1
①称取一定质量的样品,将样品溶解
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀
③将沉淀过滤、洗涤、干燥得到白色固体17.22g
实验2
①称取与实验1中相同质量的样品,将样品溶解
②向溶解后的溶液中,通入足量的Cl2
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4g
根据实验回答下列问题:
(l)溶解过程中所用到的玻璃仪器有_____________________。
(2)实验室保存FeCl2溶液时通常会向其中加入少量试剂_________和_________。
(3)实验2中通入足量Cl2的目的是____________________________________。
涉及的化学反应的离子方程式是____________________________________。
(4)简述检验实验2的步骤④中沉淀已经洗涤干净的方法
_______________________________________________________________
_______________________________________________________________。
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(方程式与文字相结合来说明)___________________________________________
______________________________________________________。
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及到胶体的性质。以下关于胶体的说法不正确的是_____________(填写序号字母)。
A. 胶体粒子能透过滤纸,但不能透过半透膜
B. 胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
C. 只有胶体粒子能作布朗运动
D. 向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失
E. 在蛋白质溶液中加入稀的CuSO4溶液,可使蛋白质盐析
(7)通过实验所得数据,计算得固体样品中FeCl3和FeCl2的物质的量之比为__________________。
(8)实验室可以采用下列装置制取少量的FeCl3固体,已知FeCl3固体易潮解。(部分夹持仪器已略去)
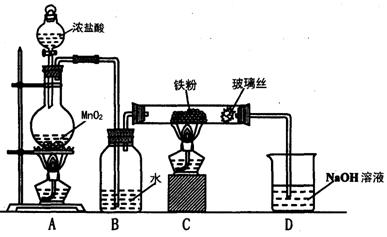
该装置存在不足,往往无法得到FeCl3固体,请你对该装置提出合理的改进措施
_______________________________________________________________。
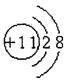
27. (14分)有A、B、C、D、E五种短周期元素,原子序数依次增大。A元素原子内无中子;B、C、D同周期;B元素原子最外层电子数是次外层的2倍;D是地壳中含量最多的元素;E与A同主族。回答下列问题:
(1)画出E元素的离子结构示意图______________。
(2)D、E形成的一种化合物甲能与B、D形成的一种化合物乙反应,生成D的单质。写出甲与乙反应的化学方程式____________________________________。
(3)采用石墨为电极,电解A、D、E三种元素所形成的一种化合物,其阳极电极反应为
_____________________________________________。
(4)A、C能形成一种常见气体丙,其分子为___________分子(填“极性”或“非极性”);丙的电子式为______________________;实验室制取气体丙的化学方程式为_________________
___________________________________。
(5)在一定条件下,lmol气体丙还可与D的单质反应,生成水蒸气和另一种气体,同时转移![]() 个电子,并放出282.8kJ的热量,试写出该反应的热化学方程式
个电子,并放出282.8kJ的热量,试写出该反应的热化学方程式
______________________________________________________。
28. (l2分)下图中A、B均为固体,其中B为单质。下图可用于工业生产F。回答下列问题:

(1)A的化学式为___________________。
(2)反应①是一个氧化还原反应,该反应发生时,每生成4mol气体C,转移电子
_________________mol。
(3)写出D与铝单质反应的化学方程式______________________。
(4)反应②是可逆反应,在2L的密闭容器中投入4molC和3molX,10分钟后反应达到平衡,平衡时混合气体共6mol,则下列说法正确的是___________(填写序号字母)。
A. 工业制取F时,C和X生成E的反应是在吸收塔进行
B. 这10分钟内,X的平均反应速率是0.lmol/(L·min)
C. 当C和X的消耗速率比为2:1时,标志着反应达到平衡
D. 平衡时C的转化率是50%
E. 在工业生产中可以通过增加X浓度来提高C的转化率
F. 工业生产中直接用水来吸收E
(5)写出过量气体C与氢氧化钠溶液反应的化学方程式
_______________________________________________________。
(6)将5mL0.02mol/L的F溶液与5mL0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH是___________。
29. (18分)光合细菌,属红螺菌科,是能以光作为能源、以二氧化碳或有机物作为碳源进行繁殖的微生物,广泛分布于湖泊、海洋、土壤中。将红螺菌科的A、B、C、D四种菌株分别接种到三角瓶培养液中,于不同光照下培养,其生长曲线如图1~图3。
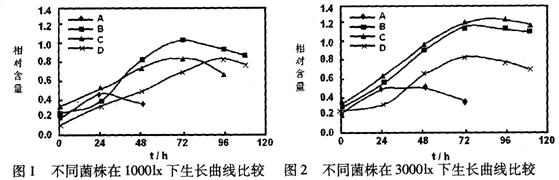
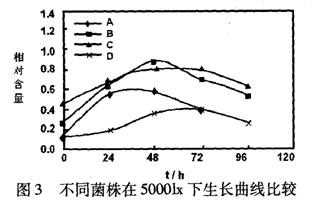
(l)由图1~图3看出:①________菌株在不同光照强度下均表现出较高的生长速率;
___________菌株在三种光照强度下生长均欠佳,________菌株在1000lx、30001x光照下生长
较好,而在50001x光照下生长很差。②光合细菌生长繁殖的较适宜光照强度为___________1x,在该光照强度下,菌体对数生长期较长,细胞数量达到较高的数值。
(2)红螺菌和人的细胞在结构上的最主要区别是______________________;二者都能合成由104个氨基酸组成的细胞色素C,则红螺菌控制合成细胞色素C的基因中编码区的脱氧核苷酸数目与人的相比应________(多/少)于人类。
(3)红螺菌可以作为鱼虾等水产动物的饵料提高产量,是因为其细胞中含有
_________________________________________营养物质(答出三种即可)。
(4)定期向养鱼虾的池塘中泼洒的红螺菌,能够抑制其它病菌生长繁殖,起到防治疾病的作用。这利用了生态因素中的_________关系。
(5)红螺菌可以防止水体富营养化。若以实验验证这一假设,可以以_________的值作为观察测量的对象。
30. (16分)骡子是马(2N=64)和驴(2N=62)杂交所得,母马与公驴的后代为马骡,母驴和公马的后代为驴骡。
(1)马骡和驴骡体细胞中染色体数是否相同?应为多少?__________________。驴骡的Y染色体上基因控制的性状应与_________(马/驴)一致。
(2)马骡和驴骡体细胞中线粒体DNA是否相同?为什么?__________________
____________________________________________________________________。线粒体中DNA与核DNA在存在形式上的主要区别是___________________________。
(3)骡子的细胞可以进行正常的_________分裂,一般不能进行正常的_________分裂。因
为_________时会发生紊乱,一般不能形成可育的配子,这反映了在马和驴这两个物种间存在着_________隔离。
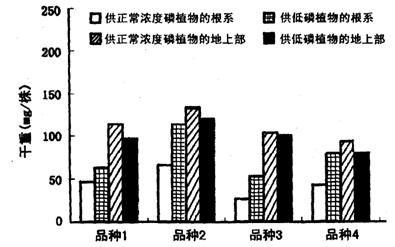
31. (14分)科研人员对低磷环境对于水稻生长的影响进行研究,得到的结果如图所示。
(1)该实验所需的材料用具除四个不同品种水稻的种子若干粒、次氯酸钠消毒液、蒸馏水、八个盛有蛭石的容器、低磷营养液、正常浓度磷营养液和清水外,还应有__________________。
(2)将实验步骤补充完整:
①将水稻种子经次氯酸钠溶液消毒后,用蒸馏水清洗2遍,37℃催芽。
②待根长至1cm左右时,将四个品种幼苗分别平均分成甲、乙两组,移至八个盛有蛭石的容器中;编号作标记。
③_______________________________________________________________。
④_______________________________________________________________。
⑤____________________________________________________________。
(3)从图中实验结果可知,低磷环境对于四个品种水稻的根系生长均有_______作用,对于不同品种的作用有差异,说明水稻根系生长状况是由_____________________决定的。
(4)低磷对于四个品种的地上部分生长有抑制作用,这是因为磷在植物体内参与_______________________________________________________________等生理过程。
(答出三个即可)
[参考答案]
第I卷
1. B 2. C 3. B 4. D 5. D
6. C 7. D 8. C 9. A 10. A
11. B 12. D 13. D 14. A 15. B
16. B 17. C 18. D 19. B 20. C
第II卷
21. (18分)
(1)10.50(3分);1.731(1.730~1.733均给分)(3分)。
(2)①BDF(3分)
②正确作出电路图(3分)
③正确作出U—I图象(3分)
④6 (3分)

22. (16分)解:
(1)汽车刹车且车轮抱死后,汽车受滑动摩擦力做匀减速运动。汽车的加速度![]() ,因
,因![]() 所以
所以![]() 。因
。因![]() ,所以这辆车是超速的。
,所以这辆车是超速的。
(2)刹车距离由两部分组成,一是司机在反应时间内汽车行驶的距离![]() ,二是刹车后匀减速行驶的距离
,二是刹车后匀减速行驶的距离![]() 。
。![]() ,则
,则![]() 。
。
23. (18分)解:
(1)小滑块从C到B的过程中,只有重力和电场力对它做功,设滑块经过圆弧轨道B点时的速度为![]() ,根据动能定理有
,根据动能定理有
![]() (4分)
(4分)
解得![]() (2分)
(2分)
(2)根据牛顿运动定律有![]() (4分)
(4分)
解得![]() (2分)
(2分)
(3)小滑块在AB轨道上运动时,所受摩擦力为![]() (2分)
(2分)
小滑块从C经B到A的过程中,重力做正功,电场力和摩擦力做负功。设小滑块在水平轨道上运动的距离(即A、B两点之间的距离)为L,则根据动能定理有
![]() (2分)
(2分)
解得![]() (2分)
(2分)
24. (20分)解:
(1)设路端电压为U,杆的运动速度为v,有![]() (2分)
(2分)
由图乙可得U=0.1t (2分)
所以速度![]() (2分)
(2分)
因为速度![]() 正比于时间t,所以杆做匀加速直线运动,
正比于时间t,所以杆做匀加速直线运动,
且加速度![]() (2分)
(2分)
(用其他方法证明可参照给分)
(2)在2s末,![]()
杆受安培力![]() (2分)
(2分)
由牛顿第二定律,对杆有![]()
得拉力![]() (2分)
(2分)
故2s末的瞬时功率![]() (2分)
(2分)
(3)在2s末,杆的动能![]()
由能量守恒定律,回路产生的焦耳热![]() (3分)
(3分)
根据![]() ,有
,有![]()
故在R上产生的焦耳热![]() (3分)
(3分)
25. (16分)
(1)![]() (1分)
(1分)
(2)A、C(2分,见错不得分)
(3)4(2分) 加成反应和取代反应(2分 见错不得分)
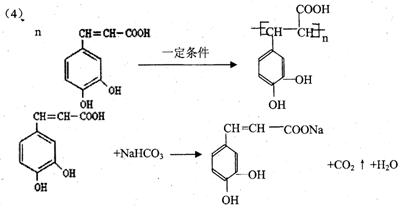
(每个方程式2分,缺条件和![]() 扣1分)
扣1分)
(5)(2分)
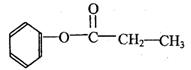
(6)![]()
或![]()
或![]()
(3分)
26. (18分)
(1)烧杯、玻璃棒(2分,见错不给分)
(2)稀盐酸 铁粉(各1分)
(3)将![]() 全部转化为
全部转化为![]() (2分)
(2分)
![]() (2分)
(2分)
(4)向洗涤后的溶液中滴加少量硝酸酸化的硝酸银溶液,如果没有白色沉淀生成,说明沉淀已经洗涤干净。(2分)
(5)![]() 在水中存在如下平衡
在水中存在如下平衡 ![]()
![]()
![]() 。在加热条件下,由于
。在加热条件下,由于![]() 易挥发,生成物浓度减小,导致平衡不断向右移动,故最后不能得到
易挥发,生成物浓度减小,导致平衡不断向右移动,故最后不能得到![]() 固体。
固体。
(方程式1分,文字说明1分)
(6)C E(2分,见错不得分)
(7)2:3 (2分)
(8)在B、C之间和C、D之间分别增加盛有浓硫酸的洗气瓶防止![]() 潮解(2分,答全给分,答不全不给分)
潮解(2分,答全给分,答不全不给分)
27. (14分,每个2分,方程式无![]() 扣1分)
扣1分)
(1)
(2)![]()
(3)![]()
(4)极性 
(5)![]()
![]()
28. (12分,每空2分)
(1)![]()
(2)![]()
(3)![]()
(缺条件扣1分)
(4)D、E(见错不得分)
(5)2![]()
(6)2
29. (每空2分,共18分)
(1)B、C;A;D;3000。
(2)无成型的细胞核,有细胞壁;少。
(3)糖类、蛋白质、脂质(也可答无机盐,答对三个给分)。
(4)竞争。
(5)水中含氧量(其它答案合理给分)。
30. (每空2分,共16分)
(1)相同,63;马。
(2)不同,因为体细胞中线粒体DNA主要来自母体,马骡的线粒体DNA来自马,驴骡的线粒体DNA来自驴;线粒体DNA是裸露的,核DNA与蛋白质形成染色体。
(3)有丝;减数;同源染色体联会;生殖。
31. (每空2分,共14分)
(1)烘干箱、天平。
(2)
③向甲组容器中加入低磷营养液、向乙组容器中加入正常浓度磷营养液。
④将上述两组幼苗放在温度、光照、空气等条件相同且适宜的环境中培养,定期适量地补充营养液。
⑤一段时间后,将幼苗取出洗净,烘干称重。
(3)促进;基因与外界环境共同。
(4)光合作用、呼吸作用、能量的转化(DNA复制、膜的合成、蛋白质合成等,答对三个给分)。