弥勒一中高三毕业班理综模拟测试题
试题1
第Ⅰ卷 (选择题 共132分)
一、在下列各题的四个选项中,只有一个选项是符合题目要求的。
 1.在普通的密封的锥形瓶中,加入含有酵母菌的葡萄糖溶液,在下图的有关坐标图中,不正确的是 ( )
1.在普通的密封的锥形瓶中,加入含有酵母菌的葡萄糖溶液,在下图的有关坐标图中,不正确的是 ( )
酒 酵 葡 溶
精 母 萄 液
浓 菌 糖 的
度 数 浓 pH
量 度 值
0 时间 0 时间 0 时间 0 时间
A B C D
 |
2.将两种仓谷害虫拟谷盗和锯谷盗共同饲养在面粉中,拟谷盗能吞食锯谷盗的卵子和蛹,下图是按(a)和(b)两种情况进行实验的结果:(a)两种害虫共同饲养在面粉中;(b)在面粉中渗入细小的短毛细管,则下列叙述中正确的是 ( )
A.两者是竞争关系 B.两者是捕食关系
C.两者是共栖关系 D.(a)曲线和(b)曲线均不能说明两者的关系
3.某种雌雄异株的植物的叶片有宽叶、狭叶之分,宽叶(B)对狭叶(b)呈显性,这种性状伴随着性别一起遗传,基因b使雄配子致死。现有两个亲本进行杂交得到的后代全为雄性个体,其中宽叶与狭叶植株各占一半,则亲本的基因型为 ( )
A.XBXB XbY B.XBXB XBY
C.XBXb XbY D.XBXb XBY
4.栽培菊花有许多的品系,其体细胞中的染色体数目分别为18、36、54、76、85、90、108、148、154、160、171等。菊花的一个正常染色体组有9条染色体,而一个异常染色体组可能有(9-1=8)条染色体,也可能有(9+1=10)条染色体。则上述11个品系中,体细胞只含正常染色体组,而且组数为偶数的多倍体品系有 ( )
A.4种 B.5种 C.6种 D.9种
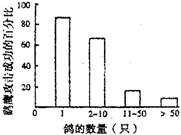 5.右图表示鹞鹰攻击不同鸽群时取得成功的概率,也
5.右图表示鹞鹰攻击不同鸽群时取得成功的概率,也
能表示鸽群防御能力的大)
①单独的鸽比在鸽群中的鸽被鹞鹰抓住的频率更小
②腹鹞鹰攻击较大的鸽群时,不太容易成功
③鹞鹰只攻击单独的鸽子
④攻击成功的比例与鸽群的数量成反比
以上说法正确的是
A.①③ B.①④ C.②④ D.②③
6. 下列关于混合物、纯净物、强电解质、弱电解质和非电解质的正确组合是 ( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A. | 盐酸 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
| B. | 冰醋酸 | 福而马林 | 硫酸钡 | 亚硫酸 | 二氧化硫 |
| C. | 单甘油酯 | 混甘油酯 | 苛性钾 | 氢硫酸 | 碳酸钙 |
| D. | 重钙 | 普钙 | 氯化钠 | 次氯酸 | 氯气 |
7.下列反应的离子方程式正确的是 ( )
A.铝片跟氢氧化钠溶液反应:AI+2OH-==== AIO2-+H2↑
B.硫酸镁溶液跟氢氧化钡溶液反应:SO42-+ Ba2+====BaSO4↓
C.碳酸钙跟醋酸反应:CaCO3+2CH3COOH====Ca2++2CH3COO-+H2O+CO2↑
D.铜片跟稀硝酸反应Cu+NO3-+4H+====Cu2++NO↑+2H2O
8. 在100mL 0.10mol/L的AgNO3溶液中加入100mL溶有2.08g BaCl2溶液,再加入100mL
溶有0.010mol的CuSO4•5H2O的溶液,充分反应。下列说法正确的是 ( )
A. 最终得到白色沉淀和无色溶液
B. 最终得到的白色沉淀是等物质的量的两种化合物的混合物
C. 在最终得到的溶液中,n(Cl-)=0.02mol
D. 在最终得到的溶液中,n (Cu2+)=0.01mol/L
9.“84”消毒夜在日常生活中被广泛使用。该消毒液无色,pH大于7,对某些有色物质有漂白作用。你认为它可能的有效成分是 ( )
A.SO2 B.Na2CO3 C.KMnO4 D.NaClO
10. 已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、
C、A的顺序依次减小,B和E同主族。下列说法不正确的是 ( )
A. A、B、E一定在不同周期 B. C的最高价氧化物的水合物可能显碱性
C. A、D可能在同一主族 D. C和D的单质可能化合形成离子化合物
11.已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g)=H2(g)+![]() O2(g) △H=+242kJ·mol-1
O2(g) △H=+242kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) △H=-484kJ·mol-1
C.H2(g)+![]() O2(g)=H2O(g) △H=+242kJ·mol-
O2(g)=H2O(g) △H=+242kJ·mol-
D.2H2(g)+O2(g)=2H2O(g) △H=+484kJ·mol-1
![]() 12. 在一密闭容器中,用等物质的量的A和B发生如下反应:A(g) +2B(g) 2C (g) ,反应达到平衡时,若混合气体A和B的物质的量的和与C的物质的量相等,则这时A的转化率为 ( )
12. 在一密闭容器中,用等物质的量的A和B发生如下反应:A(g) +2B(g) 2C (g) ,反应达到平衡时,若混合气体A和B的物质的量的和与C的物质的量相等,则这时A的转化率为 ( )
A. 40% B. 50% C. 60% D. 70%
13.有100mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2 mol·L-1,c(Cl-1)=1.3 mol·L-1要使Mg2+完全沉淀,且与Al 3+恰好分离,至少需要2mol·L-1 NaOH溶液
A.80mL B.100mL C.120mL D140mL
![]()
![]() 14. 维生素C的结构简式为HO-C = C-OH ( )
14. 维生素C的结构简式为HO-C = C-OH ( )
![]()
![]()
![]() HO―CH2―CH-C -C=O
HO―CH2―CH-C -C=O
OH O
A. 是一个环酯类化合物 B. 易起氧化及加成反应
C. 可以溶解于水 D. 在碱性溶液中能稳定存在
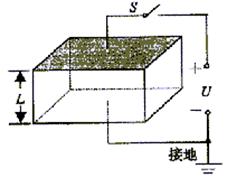
15.如图所示,为了从工事内部观察外界目标,在壁厚为d=10![]() cm、宽为L=10cm
cm、宽为L=10cm
的工事窗口上嵌入折射率为n=![]() 的玻璃砖,则当人眼在工事内部AB线上任意移动
的玻璃砖,则当人眼在工事内部AB线上任意移动
时,能看到外界的视角变化 ( )
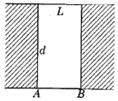 A.视角不变
A.视角不变
B.视角变小
C.视角增大到120°
D.视角增大到原来的![]() 倍
倍
16.电子的静止质量为m,一对正、负电子以很高的速度对撞后湮灭,放出一对同频率的光子,由此可以判断 ( )
A.这对光子的总能量等于2mc2 B.这对光子的总能量大于2mc2
C.光子波长等于h/mc D.光子波长大于h/mc
 17.已知放射性同位素14C的半衰期是5730年,现测得某生物化石中14C只剩下正常量的
17.已知放射性同位素14C的半衰期是5730年,现测得某生物化石中14C只剩下正常量的
1/32,说明该生物死后至今经历了大约 ( )
A.17190年 B.22920 C.28650年 D.34380年
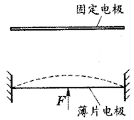
18.传感器是一种采集信息的重要器件,如图所示,是一种测定压力的电容式传感器,当待测压力F作用于可动膜片电极上时,可使膜片产生形变,引起电容的变化,将电容器、灵敏电流计和电源串接成闭合电路.那么 ( )
A.当F向上压膜片电极时,电容将减小
B.当F向上压膜片电极时,电容将不变
C.若电流计有示数,则压力F发生变化
D.若电流计有示数,则压力F不发生变化
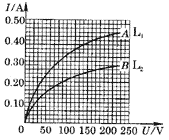 19.如图所示为白炽灯L1(规格为“220V100W”),L2(规
19.如图所示为白炽灯L1(规格为“220V100W”),L2(规
格为“220V60W”)的伏安特性曲线,则根据该曲线可确
定将L1、L2两灯串联在220V的电源上时,两灯的实
际功率之比大约为 ( )
A.1:2 B.3:5
C.5:3 D.1:3
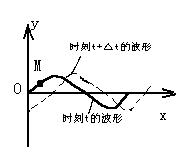 20.如图所示为一列向右传播的横波在t时刻和t+△t 时刻的波动图象。在△t时间内,就图中的某一质点M,下列表述正确的是
20.如图所示为一列向右传播的横波在t时刻和t+△t 时刻的波动图象。在△t时间内,就图中的某一质点M,下列表述正确的是
A.质点M水平向右移动了一段距离
B.质点M先向上运动,后向下运动
C.质点M的位移由正变为负
D.质点M的振动速度先变小后变大
21.质量为![]() 的小球被系在轻绳的一端,在竖直平面内作半径为
的小球被系在轻绳的一端,在竖直平面内作半径为![]() 的圆周运动,运动过程
的圆周运动,运动过程
中小球受到空气阻力的作用。设某一时刻小球通过轨道的最低点,此时绳子的张力为
7![]() ,此后小琺继续作圆周运动,经过半个圆周恰能通过最高点,则在此过程中小球
,此后小琺继续作圆周运动,经过半个圆周恰能通过最高点,则在此过程中小球
克服空气阻力所做的功为 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
22.从离地面![]() 高处水平抛出一个小球,经过时间
高处水平抛出一个小球,经过时间![]() ,小球的动能和势能相等,空气阻力不计,重力加速度为
,小球的动能和势能相等,空气阻力不计,重力加速度为![]() ,以地面为零势能参考面,则可知 ( )
,以地面为零势能参考面,则可知 ( )
①抛出点的高度![]() 满足
满足![]()
②抛出点的高度![]() 满足1/2
满足1/2![]()
③落地时的速度![]() 满足
满足![]()
④落地时的速率![]() 满足
满足![]()
A.①③ B.②③ C.①④ D.②④
弥勒一中2004届高三毕业班模拟测试题
理综试题1——答题卷
班级 学号 姓名 得分:
第I卷(共22题,每小题6分,共132分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 科目 |
|
|
|
|
|
|
|
|
|
|
|
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 科目 |
|
|
|
|
|
|
|
|
|
|
|
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷 (非选择题 共168分)
23.植物在单侧光照射下弯向光源生长。这个现象被解释为“光线能够使生长素在背光一侧比向光一侧分布多”。为什么生长素在背光一侧比向光—侧分布多?是因为向光侧的生长素在光的影响下被分解了,还是向光侧的生长素向背光侧转移了。为此,有人做了下述实验 (一)实验步骤:将生长状况相同的胚芽鞘尖端切下来,放在琼脂切块上,分别放在黑暗
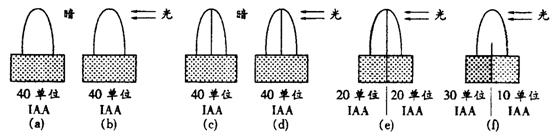 |
中和单侧光下(见图)。
(二)实验结果:如图所示。
将c、d、e和f用一生长素不能透过的薄玻璃片将胚芽鞘分割;琼脂下方的数字表示琼脂块收集到的生长素(1AA)的量)
请回答:
⑴a和b说明什么?
⑵c和d说明什么?
⑶e和f说明什么?
⑷上述实验可得出什么结论
24.农业上常用轮作来提高农作物产量。轮作就是在同一块田地上,按预定的计划,轮换种植不同作物。轮作可以提高土壤肥力,防止害虫的发生,请回答下列问题。
(1)轮作能提高土壤肥力,是由于各种作物对土壤中____________不同。
(2)轮作能防止害虫,是由于改变了原有的_____________,从而使害虫难以生存下去。
(3)你认为还可以采取什么措施,提高单位面积农作物的产量?
25.1999年11月21日,我国载人飞船“神舟”号首次试飞成功,这标志着我国的航天技
术已居世界领先地位。在长期的航天飞行中,比较难解决的问题是宇航员的食物与氧
气供应问题。科学家发现,在太空舱内“饲养”小球藻可以很好地解决这个问题,因为小球藻经过光合作用,既可释放氧气,也能合成有机物。在一般光照条件下,每500g小球藻(鲜重)经光合作用每小时约可净释放氧气224mL(标准状况)。一名宇航员要维持正确的生命活动,每小时约需氧化0.25mol的葡萄糖来提供能量。请回答下列有关问题:
(1)每公斤小球藻在光照条件下,每小时可产生________g葡萄糖。
(2)若宇航员维持生命活动所需的氧气全部来自小球藻的光合作用,则在太空舱内至
少要饲养小球藻_________kg。
(3)若宇航员每天(24小时)消耗的900g葡萄糖,全部由小球藻提供(不考虑小球藻的
自身消耗)则饲养的这些小球藻至少需光照________小时。
(4)若宇航员用“18O标记的水来培植小球藻,则经过一整天的光照后,首先出现含18O的应是 ( )
A.小球藻的光合产物C6H12O6 B.小球藻的呼吸产物CO2
C.宇航员的呼吸产物CO2 D.宇航员的尿液
(5)1987年8月,我国返回卫星上曾搭载水稻种子,返回后经地面种植,培育出的
水稻穗粒大,亩产达600kg,最高达750kg,蛋白质含量增加8%一20%,生长期平均缩短10 天。这种育种方式叫___________其优点是:______________________。
26(12分). 化合物C和E都是医用功能高分子材料,且有相同的元素百分组成,均可由化合物A(C4H8O3)制得,如下图所示,B和D互为同分异构体。
|
 | |||
| |||
|
![]()
![]()
![]()
![]()
|
|
试写出:化学方程式
A→D
B→C
反应类型:A→B B→C A→E 。
E的结构简式
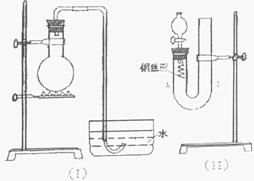 27(13分).实验室用稀硝酸与铜反应来制备NO气体,如果采用右图(I)装置(烧瓶内加入稀硝酸和铜片,必要时可加热),实验效果不十分理想,因为观察到的现象不能有力证明反应产物是NO;有人设计了(II)装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果。
27(13分).实验室用稀硝酸与铜反应来制备NO气体,如果采用右图(I)装置(烧瓶内加入稀硝酸和铜片,必要时可加热),实验效果不十分理想,因为观察到的现象不能有力证明反应产物是NO;有人设计了(II)装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果。
(1)用I装置做实验时,用排水法收集到的气体的颜色为 色;实验过程中由于观察到 现象,而不能有力证明反应产物是NO。
(2)用II装置做实验时,将有关操作补充完全:
①将分液漏斗的活塞打开,从U型管的B侧管口注入稀硝酸,一直注到
为止。
②关闭活塞,用酒精灯在U型管的A侧加热,当 时,立即撤去酒精灯。
(3)回答下列问题:
①反应在什么情况下可以自动停止?可在何处观察到无色的NO气体?
②如果再将分液漏斗的活塞慢慢打开,可立即观察到哪些明显现象?
28(12分).Ⅰ 在一定条件下,单质X和单质Y反应,生成化合物Z,Z与水作用可生成气体G和白色沉淀P(如图所示),已知气体G与空气密度之比约为1.17。
|
|
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
|
|
|
请填空:
(1)组成单质X和Y的元素分别属第 族和第 族。
(2)化合物Z的化学式为 。
(3)每生成1mol的气体G,同时应得到 mol的沉淀P。
Ⅱ 下图每一方框中的字母代表一种反应物或生成物(A的水溶液呈蓝色):
![]()
![]()
![]()
|
|
|
|
|
|
|
|
|
|
|
|
|
|
有关物质的组成如下:
| B E F | |
| 起始组成 /mol 某时刻组成 /mol | 2 4 0 1 2 2 |
从A到F均为中学化学中常见的物质,其中B跟E反应生成物质F,某温度下该反应起始和某时刻的反应混合物组成如上表表示。请写出下列反应的化学方程式。
反应①: 。
反应②: 。
反应③:(标明反应条件) 。
反应④: 。
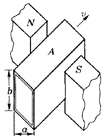 29.在原子反应堆中抽动液态金属时,由于不允许转动机械部分和液
29.在原子反应堆中抽动液态金属时,由于不允许转动机械部分和液
态金属接触,常使用一种电磁泵.如图所示是这种电磁泵的结构示
意图,图中A是导管的一段,垂直于匀强磁场放置,导管内充满
液态金属.当电流I垂直于导管和磁场方向穿过液态金属时,液态
金属即被驱动,并保持匀速运动.若导管内截面宽为a,高为b,
磁场区域中的液体通过的电流为I,磁感应强度为B.求:
【15分】
(1)电流I的方向; ;
(2)驱动力对液体造成的压强差;
(3)由于液体流动而在磁场区域的液体中产生的感应电动势的方向.
;
30.关于中子星问题:中子星是恒星演变到最后的一种存在形式。【15分】
⑴有一密度均匀的星球,以角速度ω绕自身的几何对称轴旋转。若维持其表面物质不
因快速旋转而被甩掉的力只有万有引力,那么该星球的密度至少要多大?
⑵蟹状星云中有一颗中子星,它每秒转30周,以此数据估算这颗中子星的最小密度。
⑶若此中子星的质量约为太阳的质量(2×1030kg),试问它的最大可能半径是多大?
31(9分).工业上用水煤气法制还原剂,反应物为焦炭与水蒸气,人如果不小心吸入生成物气体,则会导致煤气中毒,严重的会导致死亡,这是为什么?用1mol焦炭与足够水蒸气充分反应,生成的还原剂可以还原多少克FeO和CuO的混合物,已知这种混合物的平均相对分子质量为78。
32(10分).A、B、C是大家熟悉的与生命运动密切相关的三种化合物,它们所含元素不超过三种并有下列转化关系:
 | |||
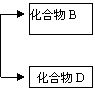 | |||
|
其中化合物D也是日常生活中常见的化合物,在一定条件下可与单质甲进一步发生如下反应:
化合物D + 3单质甲 → 3 化合物A + 2化合物B
(1)在A、B、C、D四种化合物中所含元素相同的是 、 (填写物质名称)。
(2)常温下A和B是通过什么途径转化为C的?
(3)目前,化合物B在自然界中的含量呈上升趋势,对环境产生了不良影响,发生
这种变化的主要原因是 。
(4)化合物D另有一种同分异构体,其结构简式是 。
33、实验题:有一个电阻Rx,其阻值大约在40Ω~50Ω之间,现要进一步测量其电阻,
手边现有器材如下:【15分】
电源E(电动势12V,内阻为0.5Ω);
电压表(0-3-15V,内阻约为10kΩ);
电流表(0-0.6-3A,内阻约为1Ω);
滑动变阻器R1(阻值0-10Ω,额定电流2A);
滑动变阻器R2(阻值0-1700Ω,额定电流0.3A);
电键K和导线若干.
(1)  电压表的量程应选
,电流表的量程应选 ,滑动变阻器应选用
。
电压表的量程应选
,电流表的量程应选 ,滑动变阻器应选用
。
(2) 请画出实验电路图。
(3)用笔画线代替导线,在实物图上连好实验电路.
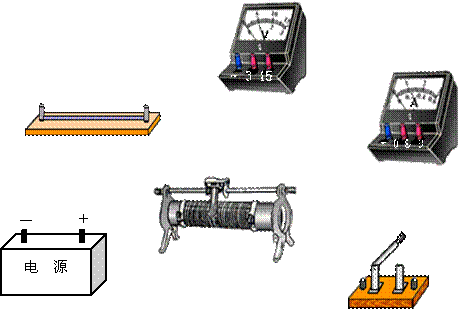 |
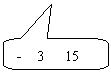 | |||
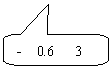 | |||
34.为研究静电除尘,有人设计了一个盒状容器,容器侧面是绝缘的透明有机玻璃,它的上下底面是面积A=0.04m2的金属板,间距L=0.05m,当连接到U=2500V的高压电源正负两极时,能在两金属板间产生一个匀强电场,如图所示,现把一定量均匀分布的烟尘颗粒密闭在容器内,每立方米有烟尘颗粒1013个,假设这些颗粒都处于静止状态,每个颗粒带电量为q=+1.0×10-17C,质量为m=2.0×10-15kg,不考虑烟尘颗粒之间的相互作用和空气阻力,并忽略烟尘颗粒所受重力。求合上电键后:(1)经过多长时间烟尘颗粒可以被全部吸附?(2)除尘过程中电场对烟尘颗粒共做了多少功?(3)经过多长时间容器中烟尘颗粒的总动能达到最大?【17分】
|
高三理科综合测试题(1)
参考答案
1. B 2. A 3. C 4. A 5. C 6. B 7.c 8. B 9. D 10. B 11. A 12. A 13. A 14.D
15.C 16.B 17.C 18.B 19.D 20.C 21、B 22、B
23.⑴光照未使生长素分解,也未影响生长素向下运输。 ⑵胚芽鞘被玻璃片分隔后,不影响生长素的向下运输,也不影响琼脂块收集生长素的数量。 ⑶单侧光照射使尖端的生长素移向背光一侧。 ⑷单侧光照射下,向光侧的生长素向背光侧转移了,而不是向光侧的生长素在光的影响下被分解了。
24.(1)矿质元素的吸收。 (2)食物链。 (3)合理密植,选育良种,建立生态农业。(另外可写:合理灌溉,合理施肥等)
25.(1)0.6 (2)75 (3)20 (4)D
![]()
![]() 26 .CH2―CH2―CH2
CH2―CH2 + H2O
26 .CH2―CH2―CH2
CH2―CH2 + H2O
![]()
![]()
![]()
![]()
![]() OH
COOH CH2 C=O
OH
COOH CH2 C=O
O
![]()
![]()
![]() nCH2=CH―CH2―COOH [ CH-CH2 ]n
nCH2=CH―CH2―COOH [ CH-CH2 ]n
![]() CH2―COOH
CH2―COOH
消去 加聚 缩聚
![]() O
O
![]()
![]() [O―CH2―CH2―CH2-C]n
[O―CH2―CH2―CH2-C]n
27(1)无,由于烧瓶内空气不易排除,生成的NO很快被氧化成红棕色NO2,不易观察到有无色NO气体生成;
(2)①单孔塞下沿与液面间不留有空隙。②铜丝上有气泡产生时。
(3)①当产生的NO气体将HNO3排入,铜丝与稀HNO3脱离后,反应即会停止。在U型管A侧中可观察到无色的NO气体。②U型管B侧管中的稀HNO3又回落到A侧管内,分液漏斗中有红棕色气体出现。
28.Ⅰ(1) ⅢA ⅥA (2)Al2S3![]() (3)2/3
(3)2/3
![]()
![]() .Ⅱ2CuSO4+2H2O 2H2SO4+2Cu+O2↑
.Ⅱ2CuSO4+2H2O 2H2SO4+2Cu+O2↑
![]()
![]() Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
![]()
![]()
![]()
![]()
![]() 2SO2+O2 2SO3
2SO2+O2 2SO3
SO3+H2O=H2SO4
29.解:(1)由左手定则判断电流的方向由下而上.(2)把液体看成由许多横切液片组成,因通电而受磁场力的作用,即F=IbB.设压强差为Δp,当液体匀速流动时,驱动力跟液体两端的压力差大小相等,即F=Δp·S,解得Δp=F/S=IB/a.
(3)因液体流动而切割磁感线,由右手定则判断感应电动势方向向下.
30.分析:⑴以该星球表面的任一物体为研究对象,利用万有引力充当向心力,星球总质量用密度乘球体积公式,可得密度表达式。⑵将ω=2πf带入密度公式,可得最小密度。⑶将质量带入公式,可得最大可能半径。
解答:⑴ ![]()
![]()
⑵ ![]()
⑶ 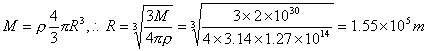
![]() 31. C+H2O CO+H2,水煤气的生成物中有CO,它与血红蛋白的结合力远远大于O2与血红蛋白的结合力,且结合时间很长不易分离,故当吸入CO时,血红蛋白就无法与O2结合,从而血液无法运输氧气,导致人体缺氧,这就煤气中毒,严重的会导致死亡。
31. C+H2O CO+H2,水煤气的生成物中有CO,它与血红蛋白的结合力远远大于O2与血红蛋白的结合力,且结合时间很长不易分离,故当吸入CO时,血红蛋白就无法与O2结合,从而血液无法运输氧气,导致人体缺氧,这就煤气中毒,严重的会导致死亡。
![]() 72 2
72 2
![]()
![]()
![]() 由十字交叉法 78 得混合物中nFeO:nCuO=1:3
由十字交叉法 78 得混合物中nFeO:nCuO=1:3
80 6
由C+H2O=CO+H2 可得1mol焦炭充分反应生成CO、H2的量分别为:n(CO)=1mol,n(H2)=1mol
由 CO + FeO=Fe+CO2
x x
CO + CuO=CuO+CO2
3x 3 x
H2 + FeO=Fe+H2O
y y
H2 +CuO=Cu+H2O
3y 3y
得![]() 则还原混合物的质量m=72(x+y)+80(3x+3y)=156g
则还原混合物的质量m=72(x+y)+80(3x+3y)=156g
32.Ⅰ(1)C:葡萄糖 D:乙醇或酒精
(2)水和二氧化碳是通过植物的光合作用转化为葡萄糖的。
(3)CO2在空气中含量呈上升趋势使“温室效应”加剧,其主要原因是:大量燃烧含碳燃料,人口膨胀,森林被大面积砍伐,工业废气、车辆尾气排放等。
(4)CH3OCH3
33、实验题 (1)15V,3A,R1 (2)分压器接法,电流表外接法 (3)短路电流(6A)
34.(1)当最靠近上表面的烟尘颗粒被吸附到下板时,烟尘就被全部吸附烟尘颗粒受到的电场力
F=qU/L ① ![]() ② ∴
② ∴![]() ③
③
(2)![]() ④ =2.5×10-4(J) ⑤
④ =2.5×10-4(J) ⑤
(3)设烟尘颗粒下落距离为x
![]() ⑥
⑥
当![]() 时 EK达最大,
时 EK达最大, ![]()
![]() ⑦
⑦