高三理科综合模拟试卷
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。共300分。考试时间150分钟。
第I卷(选择题 共120分)
 本卷共20题。在下列各题的四个选项中,只有一个选项是最符合题目要求的。
本卷共20题。在下列各题的四个选项中,只有一个选项是最符合题目要求的。
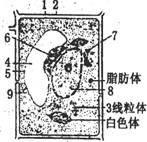
1. 如右图是正值细胞的亚显微结构模式图,下列叙述中正确的是
A.电镜下观察可判断该细胞是一个可以进行光合作用的细胞
B.2号结构的特征是具有一定的流动性,温度降低,流动性增强
C.7号结构与该细胞分泌物的形成有关
D.若该细胞是活的洋葱表皮细胞,将其置于0.3 g/mL蔗糖溶液中
后会发生质壁分离现象
2.豌豆种子萌发时的吸水过程分为I、II、III三个阶段,其吸水量随时间的变化关系如图所示。科学家研
 究发现,在第II阶段种子中O
究发现,在第II阶段种子中O![]() 的吸收量大大低于CO
的吸收量大大低于CO![]() 的释放量,而在第III阶段O
的释放量,而在第III阶段O![]() 的吸收量就显著增加。下列关于豌豆种子萌发初期生理变化的错误叙述是
的吸收量就显著增加。下列关于豌豆种子萌发初期生理变化的错误叙述是
A.第I阶段吸水与蛋白质、淀粉等物质有关
B.第II阶段呼吸作用强度最弱
C.第II阶段吸水缓慢
D.与第I阶段相比,第II阶段种子的干重有所下降
3.在适宜的温度、水分和CO![]() 条件下,分别测定强光和弱光时不同植物的净光合作用量如图,请据此判
条件下,分别测定强光和弱光时不同植物的净光合作用量如图,请据此判
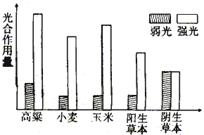 断,下列叙述不正确的是
断,下列叙述不正确的是
A.该条件下,使植物吸收CO![]() 量增加或减少的主要生态因素是光
量增加或减少的主要生态因素是光
B.植物在强光下的净光合作用量一定比弱光下高
C.同等光照条件下,玉米比小麦的净光合作用量高
D.大多数农作物都是喜阳植物
4.下图是甲状腺活动的调节示意图,对该图的理解,不正确的是
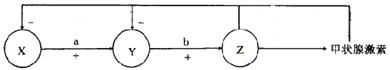 |
A.血液中的甲状腺激素含量起着反馈调节的作用,属于体液调节
B.图中a与b分别是促甲状腺激素释放激素和促甲状腺激素
C.Z的活动只受垂体促激素的调节
D.图中X与Y分别是下丘脑和垂体
5.D、d与T、t都是同源染色体上的等位基因,在不同情况下,符合叙述中因果关系的选项为
A.进行独立遗传的DDTT与ddtt杂交,F![]() 中得到具双显性性状且稳定遗传的个体比例为9/16
中得到具双显性性状且稳定遗传的个体比例为9/16
B.将DDTT基因型的个体进行花药离体培养,其后代无Dt基因型的个体
C.将基因型为DDtt的桃树枝条嫁接到基因型为ddTT的植株上,自花传粉后,所结果实的基因型为DdTt
D.后代表现型tt为1:1:1:1的两个亲本,基因型一定为DdTt和ddtt
6.关于生态系统中碳、氮、硫的循环,叙述错误的是
A.都以气体形式进入生物群落
B.都有微生物参与
C.在生物体内主要以有机物形式存在
D.三种循环均与能量流动密切相关
7.温室栽培的茄果蔬菜,因花粉发育不良,影响传粉受精,如果要保证产量,可采用的补救方法
A.喷洒N肥 B.提高CO![]() 浓度
浓度
C.喷洒P肥 D.喷洒生长素类似物
8.下列叙述中,正确的是
A.为了防止碘缺乏症,任何地域的人都应该食用加碘盐
B.为了满足人们少摄入脂肪、多食用瘦肉的需求,可在猪饲料中加入瘦肉精——盐酸克仑特罗,以生产更多的瘦肉型猪
C.要控制使用含磷洗涤剂,是因为含磷的污水排放到河流中,会引起藻类增殖,使水质恶化
D.油脂是人体必需的营养素之一,变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应
9.去年“非典”在我国广东流行,民间都用过氧乙酸(CH![]() COOOH)作为消毒剂,因它具有很强的氧化性和腐蚀性,可以迅速杀灭多种微生物,包括多种病毒(如:SARS病毒)、细菌、真菌及芽孢,有关过氧乙酸的叙述不正确的是
COOOH)作为消毒剂,因它具有很强的氧化性和腐蚀性,可以迅速杀灭多种微生物,包括多种病毒(如:SARS病毒)、细菌、真菌及芽孢,有关过氧乙酸的叙述不正确的是
A.过氧乙酸与羟基乙酸(HOCH![]() COOH)互为同分异构体
COOH)互为同分异构体
B.过氧乙酸与苯酚混合使用杀菌能力更强
C.过氧乙酸因具有强氧化性,所以有杀菌作用
D.在使用过氧乙酸消毒时并不是浓度越大越好
10.下列各组物质的晶体中,化学键类型和晶体类型都相同的是
A.SO![]() 和SiO
和SiO![]() B.CO
B.CO![]() 和H
和H![]() O C.NaCl和HCl
D.CCl
O C.NaCl和HCl
D.CCl![]() 和KOH
和KOH
11.向明矾溶液中逐滴加入一种溶液,首先能使胶体聚沉而后沉淀又消失的是
A.BaCl![]() 浓溶液 B.蒸馏水 C.NaHSO
浓溶液 B.蒸馏水 C.NaHSO![]() 浓溶液 D.氨水溶液
浓溶液 D.氨水溶液
12.25℃ 101 kPa时,1 g甲醇完全燃烧生成CO![]() 和液态水,同时放出22.68 kJ热量,下列表示该反应的热化学方程式的是
和液态水,同时放出22.68 kJ热量,下列表示该反应的热化学方程式的是
A.CH![]() OH(l)+3/2O
OH(l)+3/2O![]() (g)===CO
(g)===CO![]() (g)+2H
(g)+2H![]() O(l);
O(l);![]() H=-725.8 kJ/mol
H=-725.8 kJ/mol
B.2 CH![]() OH(l)+3 O
OH(l)+3 O![]() (g)===2 CO
(g)===2 CO![]() (g)+4 H
(g)+4 H![]() O(l);
O(l);![]() H=+145.6 kJ/mol
H=+145.6 kJ/mol
C.2 CH![]() OH(l)+3 O
OH(l)+3 O![]() (g)===2 CO
(g)===2 CO![]() (g)+4 H
(g)+4 H![]() O(l);
O(l);![]() H=-22.68 kJ/mol
H=-22.68 kJ/mol
D.CH![]() OH(l)+3/2O
OH(l)+3/2O![]() (g)===CO
(g)===CO![]() (g)+2H
(g)+2H![]() O(g);
O(g);![]() H=-725.8 kJ/mol
H=-725.8 kJ/mol
13.下列离子方程式中,正确的是
A.在氯化铝溶液中加入过量氨水:Al![]() +3OH
+3OH![]() ===Al(OH)
===Al(OH)![]()
![]()
B.在硫酸铜溶液中加入过量氢氧化钡溶液:Ba![]() +SO
+SO![]() ===BaSO
===BaSO![]()
![]()
C.在澄清石灰水中通入过量二氧化碳:OH![]() +CO
+CO![]() ===HCO
===HCO![]()
D.在碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca![]() +HCO
+HCO![]() +OH
+OH![]() ===CaCO
===CaCO![]() +H
+H![]() O
O
14.已知KClO![]() 与浓盐酸反应:KClO
与浓盐酸反应:KClO![]() +HCl
+HCl![]() KCl+Cl
KCl+Cl![]()
![]() +H
+H![]() O(未配平),若用K
O(未配平),若用K![]() ClO
ClO![]() 与H
与H![]() Cl作用,则下列说法正确的是
Cl作用,则下列说法正确的是
A.KCl中只含![]() Cl B.Cl
Cl B.Cl![]() 中只含
中只含![]() Cl
Cl
C.KCl中既含![]() Cl又含
Cl又含![]() Cl D.生成Cl
Cl D.生成Cl![]() 中
中![]() Cl与
Cl与![]() Cl个数比为1:5
Cl个数比为1:5
15.实验研究发现,当伦琴射线射向某些物质时会发生散射现象(康普顿效应),散射光中具有和入射光不同波长的光子,对上述现象的解释正确的是
A.不同波长的光子是散射物质发射的,因为伦琴射线光子的频率在散射过程中应保持不变
B.由于伦琴射线光子的能量E=hv,而散射前后光子能量不变,所以频率、波长都不变
C.由于散射前后伦琴射线光子的能量E=hv发生改变,所以频率、波长都发生变化
D.由于散射物质发射的光子和伦琴射线光子不同,而光子能量E=hv,所以散射光子中具有不同的波
长的光子
16.由四个实验测得的数据作出了如图所示的图象,已知甲组验证牛顿第二定律,乙组研究自由落体,丙组研究光电效应,丁组用单摆测重力加速度。对于图中x 、y的含义及说法正确的是
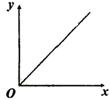 ①甲组x是作用力,y是加速度
①甲组x是作用力,y是加速度
②乙组x是时间的平方,y是位移
③丙组x是光子能量,y是光电子最大初动能
④丁组x是摆长,y是单摆简谐运动的周期
A.①② B.①③ C.②④ D.③④
17.如图所示为波沿一根一端固定的弹性轻质绳传播时的波形图,已知波已经传过固定端O,A、O间距离为半波长,则A、O间波形应为
 |
 18.如图所示,地面下有一个半圆形轨道,一小物体m可视为质点,从一端离地面高为h的A点自由落下,恰好顺着圆弧运动,从另一端D点竖直向上射出,其最高点B距地面的高度为h/2。物体从B点又自由落下,返回到左边的最高点时
18.如图所示,地面下有一个半圆形轨道,一小物体m可视为质点,从一端离地面高为h的A点自由落下,恰好顺着圆弧运动,从另一端D点竖直向上射出,其最高点B距地面的高度为h/2。物体从B点又自由落下,返回到左边的最高点时
A.低于C点 B.高于C点
C.恰在C点 D.无法确定
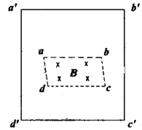 19.如图所示,虚线框abcd内为一矩形匀强磁场区域,ab=2bc,磁场方向垂直
19.如图所示,虚线框abcd内为一矩形匀强磁场区域,ab=2bc,磁场方向垂直
向里;实线框a![]() b
b![]() c
c![]() d
d![]() 是一正方形导线框,对应边相平行。若将导线框以
是一正方形导线框,对应边相平行。若将导线框以
相同速率分别平行于ab或bc方向拉出磁场,外力各自所做功为W![]() 、W
、W![]() ,
,
则应有
A.W![]() =W
=W![]() B.W
B.W![]() =2 W
=2 W![]() C.W
C.W![]() =2W
=2W![]() D.W
D.W![]() =4 W
=4 W![]()
20.质量为m、电量为q的带正电的小球在磁感应强度为B、垂直向里的水平匀强磁场中,以初速度![]() 向左运动,如图所示。已知小球和绝缘水平面间的动摩擦因数为
向左运动,如图所示。已知小球和绝缘水平面间的动摩擦因数为![]() ,经时间t、位移s后小球静止,则应有
,经时间t、位移s后小球静止,则应有
 ①s>
①s>![]() ②s<
②s<![]()
③t>![]() ④t<
④t<![]()
A.①③ B.②③ C.①④ D.②④
第II卷(非选择题 共180分)
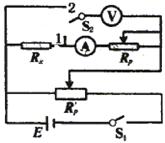 21.(19分)“伏安法”测电阻时,由于电压表、电流表内阻的影响,使得测量结果总存在误差,而按如图所示电路进行测量,则由电压表、电流表内阻所造成的误差可消除。
21.(19分)“伏安法”测电阻时,由于电压表、电流表内阻的影响,使得测量结果总存在误差,而按如图所示电路进行测量,则由电压表、电流表内阻所造成的误差可消除。
(1)请在下面操作过程中的空格填上合适的文字。
①闭合电键S![]() ,电键S
,电键S![]() 接2,调节R
接2,调节R![]() R
R![]() (填“和”或
(填“和”或
“或”),使电 表(填“压”或“流”)读数尽量接近满量
程,读出电流表和电压表读数I![]() 、U
、U![]() 。
。
②闭合电键S![]() ,让电键S
,让电键S![]() 接1,调节
使电压表读数尽量接近满量程,读出此时电压表读数U
接1,调节
使电压表读数尽量接近满量程,读出此时电压表读数U![]() 及电流表读数I
及电流表读数I![]() 。
。
③按上述操作,重复几次,测量U及I计算出电阻R![]() 的平均值。
的平均值。
(2)请你推导出待测电阻R![]() 的表达式
。(只须用U
的表达式
。(只须用U![]() 、U
、U![]() 及I
及I![]() 、I
、I![]() 来表示)
来表示)
 (3)用线把实物图按电路图连成测量电路。
(3)用线把实物图按电路图连成测量电路。
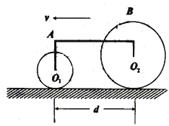 22.(16分)在水平地面上匀速行驶的拖拉机前轮直径d
22.(16分)在水平地面上匀速行驶的拖拉机前轮直径d![]() =0.8 m,后轮直径d
=0.8 m,后轮直径d![]() =1.25 m,两轮轴之间的水平距离d=2.0 m,如图所示。在行驶过程中前轮边缘最高点A处某时刻水平抛出一小石块,经
=1.25 m,两轮轴之间的水平距离d=2.0 m,如图所示。在行驶过程中前轮边缘最高点A处某时刻水平抛出一小石块,经![]() t=0.2 s后从后轮边缘最高点B处也水平飞出一小石块,这两块小石子先后落在水平路面垂直于行驶方向的同一横线上,g取10m/s
t=0.2 s后从后轮边缘最高点B处也水平飞出一小石块,这两块小石子先后落在水平路面垂直于行驶方向的同一横线上,g取10m/s![]() ,试求拖拉机行驶的速度?
,试求拖拉机行驶的速度?
23.(18分)1930年科学家们发现,在真空条件下,用a粒子(![]() He)轰击铍核(
He)轰击铍核(![]() Be)时,会产生一种看不见的、贯穿能力极强且不带电的粒子,查德威克认定这种粒子就是中子。
Be)时,会产生一种看不见的、贯穿能力极强且不带电的粒子,查德威克认定这种粒子就是中子。
(1)与出a粒子轰击铍核的核反应方程;
(2)若一个中子与一个静止的碳核发生正碰,已知中子的质量为M![]() 、初速度为
、初速度为![]() ,与碳核碰撞后
,与碳核碰撞后
的速率为![]() ,运动方向与原来运动方向相反;碳核质量视为12M
,运动方向与原来运动方向相反;碳核质量视为12M![]() ,求碳核与中子碰后的速率;
,求碳核与中子碰后的速率;
(3)若与中子碰撞后的碳核垂直于磁场方向射入匀强磁场,测得碳核做圆周运动的半径为R,已知
元电荷量为e,求该磁场的磁感应强度的大小;碳核经一周后返回原处,此时中子与碳核间的距
离是多大?
24.(12分)在锥形瓶内装入一定量液体培养基,接种N![]() 个乳酸菌之后密封,放在25℃恒温箱中连续培养若干小时,期间每30 min测定一次菌数,测得数量变化曲线如图。请分析并回答问题:
个乳酸菌之后密封,放在25℃恒温箱中连续培养若干小时,期间每30 min测定一次菌数,测得数量变化曲线如图。请分析并回答问题:
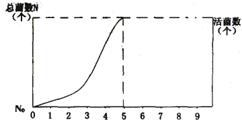
(1)乳酸菌以 方式生殖,这代表 生物普遍具有的生殖方式。
(2)用N表示总菌数,N![]() 表示初始菌数,t表示增殖世代数,乳酸菌数量增长的数学表达式为N=N
表示初始菌数,t表示增殖世代数,乳酸菌数量增长的数学表达式为N=N![]() 2
2![]()
(假设生长条件理想稳定)。当在理想条件下乳酸菌每30 min繁殖一代,按上式计算,当N![]() =1000
=1000
时,连续培养5 h,总菌数可达 个。
(3)在实际培养条件下,乳酸菌增长速度与理想条件下乳酸菌增长速度不同,如果5 h前的总菌数等
于活菌数,请在上面的图中将5 h后活菌数的变化趋势用曲线表示出来。造成菌数密度变化的外
界因素是。
(4)培养基中不断产生的乳酸来自乳酸菌的作用。
(5)实验过程中,为什么要在25的条件下进行?
25.(8分)用含有各种必需元素的溶液培养大麦。试验分为两组。一组在光下,一组在黑暗中,48小时后测定几种矿质离子的浓度。表中各离子下的数据为试验结束时,溶液中该离子的浓度与试验开始时该离子浓度之比的数值。
| 试验条件 | 水分消耗(mL) | Ca | K | Mg |
| 光下 | 1090 | 1.35 | 0.27 | 1.79 |
| 黑暗中 | 435 | 1.05 | 0.35 | 1.13 |
(1)根据上述试验结果,可以获得哪些结论?
(2)该实验属于 (探索性、验证性)实验,要保证实验成功的条件主要是 、 等
因素。
26.(16分)细心的市民一定会发现,现在许多地方产的蔬菜总体品质已明显下降了,有人生动地描述为“青菜欠绿,包菜变小,长豆变短”。农科人员指出:土质退化是导致蔬菜品质下降的主要原因。
请根据以上材料回答:
(1)多年连续种植蔬菜,极容易造成低效率的光合作用,从而引起低产量。请写出光合作用光反应
阶段的物质变化、能量变化情况 。
(2)长期施用化学肥料,会造成土地含 过高,土质偏 板结。
A.氮、磷;碱 B.碳、氧;碱
C.氮、磷;酸 D.氮、磷、钾;中性
(3)长期采用遮阳膜技术和多茬种植后,土地不易疏松活化,不利于蔬菜的根进行 ,进而
影响根对 离子的吸收过程。请写出上述一系列方程式 。
(4)农业上常采用根外追肥(即向植物叶片喷洒有机肥料和微量元素)的方法,补充植物所需的养
分。 根据有关原理,根外追肥选择在什么样的环境条件下进行效果最好?为什么?
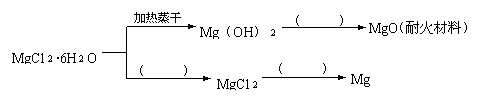 27.(15分)已知MgCl
27.(15分)已知MgCl![]() ·6H
·6H![]() O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl
O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl![]() ·6H
·6H![]() O的综合应用:
O的综合应用:
请回答下列问题:
(1)在上图中的括号内填写适当的反应条件。
![]() (2)Mg(OH)
(2)Mg(OH)![]() 固体存在如下溶解平衡:Mg(OH)
固体存在如下溶解平衡:Mg(OH)![]() (固)
Mg
(固)
Mg![]() +2 OH
+2 OH![]() 。向体系中加入
。向体系中加入
(至少填出两种不同类别的物质)
,有利于Mg(OH)![]() 溶解。
溶解。
(3)NaF和MgO的熔点分别为993℃和2852℃。试解释其可能的原因 。
28.(10分)
(1)写出下列物质的电离方程式:
①碳酸 ;
②醋酸铵 。
(2)A![]() 、B
、B![]() 、C、D四种微粒中均有氢原子,且电子总数均为10个,A
、C、D四种微粒中均有氢原子,且电子总数均为10个,A![]() 和B
和B![]() 在加热时相互反应
在加热时相互反应
可转化为C和D,则A![]() 的结构式为 ,B
的结构式为 ,B![]() 的电子式为
。
的电子式为
。
(3)在水中加入等物质的量的Ag![]() 、Na
、Na![]() 、Pb
、Pb![]() 、SO
、SO![]() 、NO
、NO![]() 、Cl
、Cl![]() ,用惰性电极电解此溶液,通
,用惰性电极电解此溶液,通
电片刻,则氧化产物与还原产物的质量比为 。
29.(15分)过氧化氢(H![]() O
O![]() )又称双氧水,常温下它是一种液体,它难电离,且易分解。作为一种经
)又称双氧水,常温下它是一种液体,它难电离,且易分解。作为一种经
典化工产品,工业上早在100年前便开始生产。随着社会需求的增长,尤其是生态环境保护的需要,
过氧化氢近年来更受到人们的青睐,被称为绿色氧化剂。为了贮存、运输、使用的方便,工业上采用
“醇析法”将其转化为固态的过碳酸钠晶体(其化学式为2Na![]() CO
CO![]() ·3H
·3H![]() O
O![]() ),该晶体具有Na
),该晶体具有Na![]() CO
CO![]()
和H![]() O
O![]() 的双重性质。“醇析法”的生产工艺过程如下:
的双重性质。“醇析法”的生产工艺过程如下:
在0℃—5℃下,往饱和的Na![]() CO
CO![]() 溶液中,先加入H
溶液中,先加入H![]() O
O![]() 和稳定剂(MgCl
和稳定剂(MgCl![]() 和Na
和Na![]() SiO
SiO![]() ),经充分
),经充分
反应后,再加入异丙醇,过滤分离,即得到过碳酸钠晶体。
根据上述材料,回答下列问题:
(1)依据你已有的知识,写出H![]() O
O![]() 的结构式
。
的结构式
。
(2)你认为H![]() O
O![]() 被称为绿色氧化剂的主要原因是:
。
被称为绿色氧化剂的主要原因是:
。
(3)我们知道,稀硫酸不与铜反应,但在稀硫酸中加入H![]() O
O![]() 后,则可使铜顺利溶解,写出该反应
后,则可使铜顺利溶解,写出该反应
的离子方程式: 。
(4)稳定剂能与水反应生成难溶物,将过碳酸钠粒子包裹住,该反应的化学方程式为:
。
(5)下列物质能使过碳酸钠较快失效的是 。
A.MnO![]() B.H
B.H![]() S C.稀H
S C.稀H![]() SO
SO![]() D.NaHCO
D.NaHCO![]()
30.(15分)PMAA是一种“智能型”有机高分子化合物,可应用于生物制药中大分子和小分子的分离。
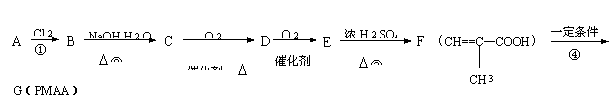 可以用下面的设计方案合成:
可以用下面的设计方案合成:
请填写下列空白:
(1)写出A、G的结构简式:A: ,G: 。
(2)①②③④反应中属于取代反应的有 。
(3)写出C![]() D的化学方程式:
。
D的化学方程式:
。
(4)C与F在浓硫酸存在和加热条件下能够充分反应,此反应的反应类型是 ,1 mol C
最多能与 (填物质的量)F完全反应。
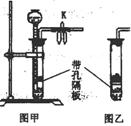 31.(15分)实验室可用下图甲装置来制取CO
31.(15分)实验室可用下图甲装置来制取CO![]() 气体,可达到随开随停的效果。
气体,可达到随开随停的效果。
(1)当打开甲装置中的止水夹时,产生的现象是: 。
(2)写出实验室用甲装置制取CO![]() 的离子方程式:
。
的离子方程式:
。
(3)甲装置中长颈漏斗下端管口应处于隔板之下的理由是: 。
(4)下列气体不宜用甲装置来随开随停地制取的是 。
A.用电石制乙炔
B.用NaOH固体和浓氨水制氨气
C.用锌粉和稀盐酸制氢气
(5)若用图乙装置来制取CO![]() ,欲想需要时产生CO
,欲想需要时产生CO![]() ,不需要时反应暂停,其操作方法是:
,不需要时反应暂停,其操作方法是:
。
 32.(21分)磁悬浮列车的原理如图所示,在水平面上两根
32.(21分)磁悬浮列车的原理如图所示,在水平面上两根
平行直导轨间有竖直方向且等距离的匀强磁场B![]() 和B
和B![]() ,
,
导轨上有金属框abcd,当匀强磁场B![]() 和B
和B![]() 同时以速
同时以速
率![]() 沿直导轨向右运动时,金属框也会沿直导轨运动。
沿直导轨向右运动时,金属框也会沿直导轨运动。
设直导轨间距L=0.4 m,磁感应强度B![]() = B
= B![]() =1.0 T,磁场运动的速率
=1.0 T,磁场运动的速率![]() =5.0 m/s,金属框电阻R=2.0
=5.0 m/s,金属框电阻R=2.0![]() ,
,
试求:
(1)金属框为什么会移动?若金金属框不受阻力作用,框如何运动?
(2)当金属框始终受到f =1.0 N阻力时,金属框运动的最大速度是多少?
(3)当金属框始终受到1.0 N阻力时,要使金属框维持最大速度,每秒需要消耗多少能量?这些能量
是由谁提供的?
高三模拟试卷答案
1.D 该细胞有液泡,在0.3 g/mL蔗糖溶液中会发生质壁分离
2.B 种子在第I阶段先进行吸胀吸水,第II阶段进行渗透吸水,该阶段呼吸作用开始增强,也包括少量的有氧呼吸,而第III阶段有O![]() 呼吸旺盛,需要的水更多。
呼吸旺盛,需要的水更多。
3.B 主要考查识图表能力,在该图中阴生植物在强光和弱光下净光合作用量几乎相等。
4.C 动物体内内分泌腺的活动大都受双重调节,即神经调节和激素调节。
5.B 选项A纯合体应为1/16;选项C应为DDtt,因为纯合体(DDtt)自交的结果还是纯合体;选项D还可能的基因型为Ddtt和ddTt。
6.A 碳、氮、硫的循环,除碳以CO![]() 的形式进入生物群落外,氮和硫都有一部分是以无机物形式进入生物群落的。
的形式进入生物群落外,氮和硫都有一部分是以无机物形式进入生物群落的。
7.D 生长素具有防止落花落果的作用。
8.C 氮、磷多是富营养化的根源。
9.B 已知过氧化酸具有强氧化性,从而具有杀菌消毒作用,而选项B中苯酚易被氧化,故二者混合时由于氧化还原反应而使二者的杀菌消毒作用都削弱或消失。
10.B A中化学键的类型相同但SO![]() 和SiO
和SiO![]() 分别是分子晶体和原子晶体,C、D中键的类型及晶体类型都不同。
分别是分子晶体和原子晶体,C、D中键的类型及晶体类型都不同。
11.C 明矾溶液中存在Al(OH)![]() 胶体,由于Al(OH)
胶体,由于Al(OH)![]() 胶粒表面带有正电荷,故电解质电离出来的阴离子均能中和其电性而使其沉聚,如A中的Cl
胶粒表面带有正电荷,故电解质电离出来的阴离子均能中和其电性而使其沉聚,如A中的Cl![]() 、C中的SO
、C中的SO![]() ,当然聚沉效果是SO
,当然聚沉效果是SO![]() 好;随着加入量的增多,C中的H
好;随着加入量的增多,C中的H![]() 与Al(OH)
与Al(OH)![]() 中和使Al(OH)
中和使Al(OH)![]() 溶解。
溶解。
12.A 由题意可知1 mol甲醇放出热量22.68 kJ/g×32 g/mol=725.8 kJ/mol。
13.C A中氨水弱电解质应写分子的形式;B中还有Cu(OH)![]() 沉淀;D反应后Ca
沉淀;D反应后Ca![]() 与CO
与CO![]() 物质的量比为2:1,CO
物质的量比为2:1,CO![]() 不能沉淀完全。
不能沉淀完全。
14.D 产物中0价的Cl来自于+5价Cl的降低和-1价Cl的升高,氧化还原反应中升、降总价数相等,故Cl![]() 中+5价Cl与-1价Cl为1:5,即
中+5价Cl与-1价Cl为1:5,即![]() Cl与
Cl与![]() Cl物质的量比为1:5。
Cl物质的量比为1:5。
15.C 康普顿效应的特点是光子和实物粒子如原子、电子发生的碰撞,在碰撞中满足动量守恒,由于实物粒子质量远大于光子质量,碰后的光子能量都会减少,由光子能量E = hv = h![]() 可知,频率会变小,波长会变大。
可知,频率会变小,波长会变大。
16.A 甲组的关系是a=![]() ,当m一定时,a∝F,故①正确;乙组的关系是s=
,当m一定时,a∝F,故①正确;乙组的关系是s=![]() ,g为重力加速度,s∝t
,g为重力加速度,s∝t![]() ,故②正确;丙组的关系是E
,故②正确;丙组的关系是E![]() =E-W,对同一种金属时,逸出功W一定,E
=E-W,对同一种金属时,逸出功W一定,E![]() 与E = hv为线性关系,不正确;丁组的关系是T=2
与E = hv为线性关系,不正确;丁组的关系是T=2![]() ,T∝
,T∝![]() ,故不正确。
,故不正确。
17.A 由于绳上波已传至O点,且此时y![]() 为正最大,O为平衡位置,
为正最大,O为平衡位置,
因此,应为四个选项中的A,即入射波和O处反射波的叠加,
如图所示,反射波正好是![]() 与入射波
与入射波![]() 相同,出现驻波。
相同,出现驻波。
18.B 小物体m从A到B的过程中,始末位置动能为零,根据动能定理可知,重力做的正功恰好等于CD圆弧上的摩擦力做的负功,有W![]() =mgh/2。当小物体从B返回C时,由于B点比A点低,沿圆弧运动时的速率比第一次小,所需向心力比第一次小,小物体对圆周的压力减小,故摩擦力减小,摩擦力做的功比mgh/2小,因此小物体运动到C点时还有动能,它会运动到高于C点,选B项。
=mgh/2。当小物体从B返回C时,由于B点比A点低,沿圆弧运动时的速率比第一次小,所需向心力比第一次小,小物体对圆周的压力减小,故摩擦力减小,摩擦力做的功比mgh/2小,因此小物体运动到C点时还有动能,它会运动到高于C点,选B项。
19.B 外力做功W=F![]() =
=![]() ,当平行于ab方向拉时W
,当平行于ab方向拉时W![]() =
=![]() ·
·![]() =
=![]() ;当平行于bc方向拉时W
;当平行于bc方向拉时W![]() =
=![]() ·
·![]() =
=![]() ,故
,故![]() =
=![]() 。
。
20.B 小球受洛伦兹力作用,由左手定则其方向向下,故在小球停止之前,其减速运动的加速度a>![]() ,所以位移s<
,所以位移s<![]() ;②正确;由于速度的减小,洛伦兹力也减小,同时使支持力、摩擦力均减小,加速度a<
;②正确;由于速度的减小,洛伦兹力也减小,同时使支持力、摩擦力均减小,加速度a<![]() ,故t>
,故t>![]() ;③正确。
;③正确。
21.(1)①和 压 ②R![]()
(2)R![]() =
=![]()
 (3)连线后实物图如下:
(3)连线后实物图如下:
22.对A处石块,水平距离x![]() =
=![]() ,对B处石块,水平距离x
,对B处石块,水平距离x![]() =
=![]() ,且
,且![]() ,及x
,及x![]() -x
-x![]() =d-
=d-![]() ,故
,故![]() =5 m/s。
=5 m/s。
23.(1)![]() Be+
Be+![]() He
He![]()
![]() C+
C+![]() n
n
(2)由动量守恒M![]() =M
=M![]() +12M
+12M![]() ,可得
,可得![]() =
=![]()
(3)由洛伦兹力充当向心力:q![]() B=
B=![]() ,故R=
,故R=![]() ,可解B=
,可解B=![]() ,其周期T=
,其周期T=![]() =
=![]() ,
,
故此时中子与碳核间距离L=![]() T=
T=![]() 。
。
24.(1)分裂 原核
(2)1000×2![]() =
=
(3)外界营养物质不断消耗
 |
(4)发酵
(5)酶作用的最适温度
25.(1)①植物吸收水和吸收矿质离子是两个相对独立的过程;②在光下的蒸腾作用比黑暗中强;③植物
对矿质离子的吸收具有选择性;④对矿质离子的吸收也受光的影响。
 (2)探索性 两组大麦的生长状况要完全一致 温度相同
(2)探索性 两组大麦的生长状况要完全一致 温度相同
26.(1)2H![]() O
4H
O
4H![]() +4e
+4e![]() +O
+O![]()
![]()
![]() NADP
NADP![]() +2e
+2e![]() +H
+H![]() NADPH
NADPH
ADP+Pi+光能转换的电能 ATP
(2)C
(3)有氧呼吸 矿质元素
![]() C
C![]() H
H![]() O
O![]() +6H
+6H![]() O+6O
O+6O![]() 6CO
6CO![]() +12H
+12H![]() O+硅 CO
O+硅 CO![]() + H
+ H![]() O
O ![]() H
H![]() CO
CO![]()
![]() H
H![]() +HCO
+HCO![]()
(4)无风或少风的傍晚,或空气湿度大的阴天。原因:使叶片液面保留更长时间,以利于植物细胞
充分吸收溶于水中的养分。
27.(1)加热灼烧 在干燥的氯化氢气流中加热 电解
MgCl![]() ·6H
·6H![]() O在干燥的氯化氢气流中加热能抑制Mg
O在干燥的氯化氢气流中加热能抑制Mg![]() 水解得到无水MgCl
水解得到无水MgCl![]() 。
。
(2)酸类:盐酸、硫酸、硝酸等,强酸弱碱盐类:硫酸铜、氯化铁等,铵盐类:醋酸铵等。
Cu![]() 、Fe
、Fe![]() 、NH
、NH![]() 更易结合OH
更易结合OH![]() 使Mg(OH)
使Mg(OH)![]() 溶解平衡正向移动。
溶解平衡正向移动。
(3)两种物质同是离子晶体,MgO比NaF键长短(或MgO比NaF核间距离小),Mg![]() 、O
、O![]() 所带电荷
所带电荷
多(离子之间作用力大),离子晶体的熔点也显著升高。(答出其中一点就给分)
28.(1)①H![]() CO
CO![]()
![]() H
H![]() +HCO
+HCO![]() HCO
HCO![]()
![]() H
H![]() + CO
+ CO![]() (二级电离不写也可以)
(二级电离不写也可以)
②CH![]() COONH
COONH![]() ===CH
===CH![]() COO
COO![]() +NH
+NH![]()
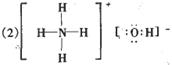 |
(3)8:1
29.(1)H—O—O—H
(2)H![]() O
O![]() 参加反应后产物是H
参加反应后产物是H![]() O,无污染。
O,无污染。
(3)Cu+ H![]() O
O![]() +2H
+2H![]()
![]() Cu
Cu![]() +2H
+2H![]() O
O
(4)MgCl![]() +Na
+Na![]() SiO
SiO![]() +3H
+3H![]() O
O![]() 2NaCl+Mg(OH)
2NaCl+Mg(OH)![]()
![]() +H
+H![]() SiO
SiO![]()
![]()
(5)MnO![]() 、H
、H![]() S、稀H
S、稀H![]() SO
SO![]()
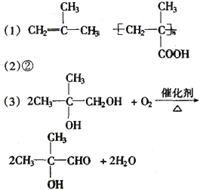
30.
(4)酯化反应 2 mol
31.(1)长颈漏斗内的液体下降,试管中的液面上升,当液体与石灰石接触后,有大量气泡产生;
(2)CaCO![]() +2H
+2H![]() ===Ca
===Ca![]() + CO
+ CO![]()
![]() + H
+ H![]() O;
O;
(3)当关闭开关K时,装置内气压增大,只有漏斗下端管口处于隔板之下,才能让液体通过漏斗使液
体与石灰石分离,达到随开随停的目的。
(4)A、B、C
(5)其操作方法是:倾斜乙装置,让块状固体与液体接触便能产生气体,若要停止气体产生,则竖直
并固定乙装置便可。
32.(1)当匀强磁场B![]() 、B
、B![]() 向右运动时,金属框相对磁场向左运动,在框中产生逆时针方向的感应电流,
向右运动时,金属框相对磁场向左运动,在框中产生逆时针方向的感应电流,
并受到向右的安培力,所以框随磁场向右运动,初时框加速,当速度增至5 m/s时,相对磁场静止,
框向前匀速运动;
(2)当阻力恒为f=1 N时,2ILB=f,及I=![]() ,可解出
,可解出![]() =1.9 m/s。
=1.9 m/s。
(3)消耗的能量有两部分:一是转化为金属框中的电热,二是克服阻力做功,故消耗功率P=I![]() R+f
R+f![]()
=5W,这些能量由磁场提供。