高二生物第一学期期中考试
高二化学 命题人:孙丽丽
原子质量: H 1 C 12 N 14 O 16 Na 23 S 32 K 39 Cl 35.5 Fe 56 Ag 108
说明:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共8页,28道题,
满分值:110分,考试时间:100分钟。考生只交第Ⅰ卷的答题卡和第Ⅱ卷。
第Ⅰ卷(选择题)共66分
一、选择题(本题包括22小题,每小题3分,共66分,每小题只有一个正确答案)
1、下列溶液中,加入10mL盐酸溶液时,其PH不会改变的是 ( )
A.20mL同一浓度的盐酸溶液; B.20mLNH4Cl溶液;
C.10mLH2O; D.10mL稀氢氧化钠溶液;
2、能促进水的电离平衡,并使溶液中的C ( H+ )﹥C (OH-)的措施是: ( )
A.向纯水中加入少量的浓盐酸 B.将水加热煮沸
C.向水中加入![]() D.向水中加入
D.向水中加入![]()
3、“绿色化学”是人们最近提出的一个新概念,主要内容之一是指从技术经济上设计可行的化学反应,尽可能减少对环境的负作用,下列化学反应符合绿色化学概念的是( )
A .CuSO4:Cu+2H2SO4(浓)=CuSO4+SO2+2H2O
B .CuSO4:2Cu+O2=2CuO,CuO+H2SO4(稀)=CuSO4+H2O
C. Cu(NO3)2:3Cu+8HNO3(稀)=3Cu(NO3)+2NO+4H2O
D. Cu(NO3)2:Cu+4HNO3(浓)=Cu(NO3)2+2NO2+2H2O
4、在一定温度下H2(g)+I2(g)![]() 2HI(g),达到平衡的标志是
( )
2HI(g),达到平衡的标志是
( )
A.单位时间内生成n mol H2,同时生成n mol I2
B.容器内气体的总压强不随时间变化
C.单位时间内生成2n mol HI,同时生成n mol I2
D.V(HI)=2V(I2)(V为体积)
5、下列离子方程式中,能正确表示盐类水解的是 ( )
A.NH+ 4+H2O![]() NH3·H2O+H+ B.HCO- 3+H2O
NH3·H2O+H+ B.HCO- 3+H2O![]() H3O++CO2-
3
H3O++CO2-
3
C.CO2- 3+2H2O![]() H2CO3+2OH- D.Al3++3H2O
H2CO3+2OH- D.Al3++3H2O![]() Al(OH)3↓+3H+
Al(OH)3↓+3H+
6、常温下、由水电离的氢离子的浓度为:![]() 、无色透明溶液中,一定能大量共存的离子组是
( )
、无色透明溶液中,一定能大量共存的离子组是
( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
7、为了使0.1mol/L的碳酸钾溶液中的碳酸根离子浓度更接近于0.1mol/L,下列可以采取的措施是: ( )
A.加入少量的盐酸 B.加入适量的水
C.加入适量的KOH D.加热
8、向纯水中加入少量的硫酸氢钠固体(温度不变),则溶液的 ( )
A.pH升高 B.C(OH-)不变
C.水中c(H+)与c(OH-)的乘积增大 D.C(OH-)减小
9、下列说法正确的是 ( )
A. 在Na3PO4溶液中,c(Na+)是c(PO43-)的3倍
B.PH为3的盐酸中,其c(H+)是PH为1的盐酸中的3倍
C.0.1mol/LKOH溶液和0.1mol/L氨水中,其c(OH-)相等
D.在25℃时,无论是酸性、碱性还是中性的溶液,其c(H+)和c(OH-)的乘积都等于1×10-14
10、在0.1mol/L的Na2CO3溶液中,下列关系式正确的是 ( )
A. C(Na+)>C(CO32-)>C(H+)>C(OH-)
B. C(Na+)+C(H+)=C(HCO3-)+C(OH-)+2 C(CO32-)
C. C(Na+)=C(CO32-)>C(OH-)>C(H+)
D. C(Na+)=2C(CO32-)
11、在一定温度下,将1molCO和1mol水蒸气放入一容积固定的密闭容器中,反应H2O(g)+CO(g)![]() CO2(g)+H2(g)平衡后,得到0.6molCO2,再通入0.4mol水蒸气,达到平衡后,CO2的物质的量可能为 ( )
CO2(g)+H2(g)平衡后,得到0.6molCO2,再通入0.4mol水蒸气,达到平衡后,CO2的物质的量可能为 ( )
A.1.0mol B.0.8mol C.0.6mol D.0.4mol
12、对于可逆反应A(g)+2B(g)![]() 2C(g)(正反应为吸热反应),下列图象中正确的是 ( )
2C(g)(正反应为吸热反应),下列图象中正确的是 ( )
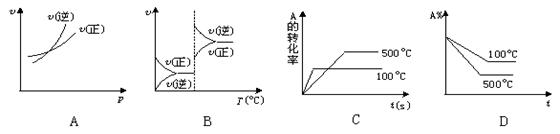 13、对于可逆反应A(g)+2B(g)
13、对于可逆反应A(g)+2B(g)![]() 2C(g)(正反应为吸热反应)达到平衡时,要
2C(g)(正反应为吸热反应)达到平衡时,要
使正反应速率降低,且使A的浓度增大,应采取的措施是 ( )
A.增大压强 B.减少A的浓度 C.减少B的浓度 D.升高温度
14、在一种一元碱ROH的溶液中,加入一种一元酸HA溶液,当反应后溶液呈现中性,下列判断中一定正确的是 ( )
A.加入的一元酸HA过量 B.生成的盐RA不能发生水解
C.加入的酸与碱的物质的量相等 D.反应后溶液中C(A-)=C(R+)
15、常温下、在CH3COONa溶液中滴加醋酸溶液至pH为7,则溶液中C(CH3COO-)与C(Na+)的关系是: ( )
A.C(CH3COO-)>C(Na+) B.C(CH3COO-)<C(Na+)
C.C(CH3COO-)= C(Na+) D.无法确定
16、在一密闭容器中进行如下反应:2SO2(气)+O2(气)![]() 2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
(
)
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
(
)
A.SO2为0.4mol/L、O2为0.2mol/L B.SO2为0.25mol/L
C.SO2、SO3均为0.15mol/L D.SO3为0.4mol/L
17、 已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是 ( )
①生成物的百分含量一定增加 ②生成物的产量一定增加 ③反应物的转化率一定增大 ④反应物的浓度一定降低 ⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂 ( )
A. ①② B. ②⑤ C. ③⑤ D. ④⑥
18、已知甲为恒温恒压容器,乙为恒温恒容容器。两容器中均充入2mol SO2、1mol O2,初始时两容器的温度体积相同。一段时间后反应2SO2+O2![]() 2SO3(正反应为放热)达到平衡,为使两容器中的SO2在平衡混合物的物质的量分数相同,下列措施中可行的是
( )
2SO3(正反应为放热)达到平衡,为使两容器中的SO2在平衡混合物的物质的量分数相同,下列措施中可行的是
( )
A.向甲容器中充入一定量的氦气 B.向甲容器中充入一定量的SO3气体
C.升高乙容器的温度 D.增大甲容器的压强
19、一定量的稀硫酸与过量的锌反应,为减慢反应速率,且不影响生成氢气的总量,可向稀硫酸中加入适量的 ( )
A.碳酸钠溶液 B.氧化铁固体 C.硝酸钾溶液 D.硫酸铜固体
20、下列说法不正确的是 ( )
A.配制氯化铁溶液时,先将氯化铁溶于较浓的盐酸中,然后再用水稀释到所需的浓度; B.为了除去氯化钾溶液中含有的少量氯化铁,可以采用加热的方式促进氯化铁水解, 使其生成氢氧化铁沉淀;
C.可以用蒸发结晶的方式,从氯化铝溶液中获得氯化铝晶体;
D.明矾在水中能够发生水解生成氢氧化铝胶体,因而可以达到净水的目的。
21、广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中的物质和水解分别离解成两部分,然后再重新两两组合成新的物质。根据上述信息,下列说法不正确的是 ( )
A.CaO2的水解产物是Ca(OH)2和H2O2
B.PCl3的水解产物是HClO和PH3
C.NaClO的水解产物之一是HClO
D.Mg3N2 水解产物是两种碱
22、有四种物质的量浓度相同,由一价阳离子A+ 和B+ 与一价阴离子X- 和Y- 组成的盐溶液,常温下测定AX和BY溶液的PH=7,AY溶液PH>7,BX溶液PH<7,由此判断可能不水解的盐是 ( )
A.BX B.AX C.AY D.BY
第Ⅱ卷(非选择题)共44分
二、填空题
23、(6分)化学反应2A+B![]() 2C达到化学平衡时,根据以下条件选择正确的选项填空.
2C达到化学平衡时,根据以下条件选择正确的选项填空.
(1)升高温度时,C的量增加,此反应______.
①是放热反应; ②是吸热反应;
③没有显著的热量变化; ④原化学平衡没有发生移动.
(2)如果A、B、C都是气体,达到平衡时减小压强,那么______.
①平衡不移动; ②平衡向正反应方向移动;
③平衡向逆反应方向移动; ④C的浓度会增大.
(3)如果已知B是气体,增大压强时,化学平衡向逆反应方向移动,那么______.
①A是气体、C是固体; ②A、B、C都是气体;
③A、C都是固体; ④A是固体、C是气体.
24、(6分)一定量的混合气体在密闭容器中反应mA(g)+nB(g) ![]() pC(g),达到平衡后,温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.9倍,若压缩过程中温度不变,请回答下列问题:
pC(g),达到平衡后,温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.9倍,若压缩过程中温度不变,请回答下列问题:
(1)方程式中的前后计量数的大小关系是 。
(2)达到新平衡态后,A物质的转化率 ,
![]() 值 (填“增大”“减小”或“不变”)。
值 (填“增大”“减小”或“不变”)。
25、(4分)回答下列有关问题:
![]() (1) 反应:2A(气) B(气) + xC(气),,在一定的条件下达到平衡状态,当密闭容器中的压强增大了P%时, 测得A的转化率增大了B%, 则x
的值为 ___________。
(1) 反应:2A(气) B(气) + xC(气),,在一定的条件下达到平衡状态,当密闭容器中的压强增大了P%时, 测得A的转化率增大了B%, 则x
的值为 ___________。
![]() (2) 在容积相同的两密闭容器A和B中, 保持温度为
423K, 同时向A和B中分别加入 a mol 和
b mol 的HI(a > b), 待反应::2HI(气) H2(气) + I2(气)达到平衡后,
用 “ > < 或
=” 来回答两种情况下的下列问题:
(2) 在容积相同的两密闭容器A和B中, 保持温度为
423K, 同时向A和B中分别加入 a mol 和
b mol 的HI(a > b), 待反应::2HI(气) H2(气) + I2(气)达到平衡后,
用 “ > < 或
=” 来回答两种情况下的下列问题:
① 从反应开始到达到平衡所需要时间::A_______ B
② 平衡时的氢气的浓度: A_______ B
③平衡时HI的体积百分含量 A B
26、(7分)用实验测定某酸HA是弱电解质。两同学的方案如下:
甲:取一定量的HA配制0.1mol/L的溶液100mL;用PH试纸测出该溶液的PH,即可证明HA是弱电解质。
乙:①用已知浓度的HA溶液、盐酸,分别配制PH=1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释到100mL;
③各取相同体积的两种稀释液装入两支试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
请问:
(1)、甲方案中,若PH 1(选择>,<,=),即可证明HA是弱电解质。
(2)、乙方案中哪些现象可以证明其是弱电解质
A.装盐酸的试管产生的H2速度快;
B.装HA溶液的试管放出的H2速度快;
C.两个试管产生气体的速度一样快。
(3)、请你再提出一个合理而又比较容易进行的方案(所有用品可任意选取),作出简单的描述
______________________________________________________________________
27、(15分)实验室中常用中和滴定、氧化还原滴定方法测定未知浓度的某反应物的物质的量浓度或测定某样品的纯度。
(1)请回答下列关于指示剂的选用问题
①用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,应选择 作指示剂。滴定操作中,左手应 ,右手应 ,眼睛注视 。
②用已知浓度的硫代酸钠滴定未知浓度的碘水时,应选择 作指示剂。(有关反应的化学方程式2Na2S2O3+I2=Na2S4O6+2NaI)
③用已知浓度的高锰酸钾溶液滴定未知浓度的硫酸亚铁酸性溶液时, 指示剂(填需要或不需要),滴定终点颜色变化为: 。高锰酸钾溶液应装在 滴定管中(填酸式或碱式)。
(2)用已知浓度为的盐酸滴定未知浓度稀氢氧化钠溶液时,为减小误差,在选用盐酸的物质的量浓度和体积时,下列四个选项中最佳的是 (填选项字母)。
A.1mol·L-1、50mL B.0.2 mol·L-1、25mL
C.0.02 mol·L-1、5mL D.5 mol·L-1、5mL
(3)用已知浓度为的盐酸滴定未知浓度稀氢氧化钠溶液时,下列操作对结果是否造成影响? (A、无影响 B、偏高 C、偏低)
装氢氧化钠溶液的锥形瓶没有用氢氧化钠溶液润洗; ( )
将氢氧化钠溶液移入锥形瓶的过程中滴定管没有润洗; ( )
装盐酸的滴定管在滴定前有气泡,滴定后无气泡; ( )
28、(6分)在2L密闭容器中,充入1 mol N2和3mol H2,一定条件下发生合成氨反应,2min时达到平衡。测得平衡混合气中NH3的体积比为25%,求:
⑴氢气的反应速率是多少?
⑵ N2的转化率?
⑶ H2在平衡时的体积分数?