高中理综生物第二次能力测试题
理科综合能力测试
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷两部分,满分300分. 考试时间150分钟。
注意事项:
1.答卷前将学校、班级、姓名填写清楚。
2.第I卷每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑。
第II卷各小题用钢笔或圆珠笔将答案直接写在试题卷上。
第Ⅰ卷(选择题 共120分)
本卷共21小题,每小题6分,共126分。在每小题的四个选项中,选出符合题目要求的一项。
可能用到的相对原子质量是:H 1 C 12 N 14 O 16 Mg 24 Al 27 S 32 Cl 35.5 Fe 56 Ag 108 Ba 137
1. 用含32P的完全培养液培养大麦幼苗,几天后测试大麦根尖不同区域32P的累积量和运输情况,结果如下表。以下叙述不正确的是( )
| 与根冠的距离(mm) | 1 | 3 | 5 | 7 | 10 | 15 | 20 | 30 | 40 | 50 | 60 | 70 | |
| 32P放射性强度相对值 | 运输 | 0 | 3 | 5 | 9 | 12 | 18 | 28 | 32 | 33 | 31 | 26 | 14 |
| 累积 | 28 | 15 | 8 | 9 | 10 | 11 | 12 | 13 | 12 | 10 | 13 | 13 | |
A. 根吸收磷元素的主要区域在距根冠20~
B. 在距根冠1~
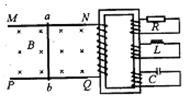
C. 几天后在幼苗叶片中检测到32P放射性,则光反应的产物中,含32P的有机物是ATP和NADPH
D. 实验两天后幼苗出现萎蔫现象,可能是营养液的浓度大于细胞液浓度,细胞失水造成的
2. 美国两位科学家安德鲁·法尔和克雷格·格洛因发现了RNA干扰机制获得2006年诺贝尔奖。他们首次将双链RNA导入线虫细胞中,发现双链RNA较单链RNA更能高效地特异性阻断相应基因的表达,把这种现象称为RNA干扰。在生物体内双链RNA可以是基因表达的产物。以下四项叙述中不能体现此项研究成果的具体应用是( )
A. 利用RNA干扰技术可使细胞中某些基因不表达来决定一个细胞的分化方向
B. 利用RNA干扰技术对外源目标基因进行特异性的表达阻断来推导该基因的功能
C. 利用RNA干扰技术可抑制肿瘤基因的表达
D. 利用RNA干扰技术可以研究某些信使RNA如何翻译成蛋白质的过程
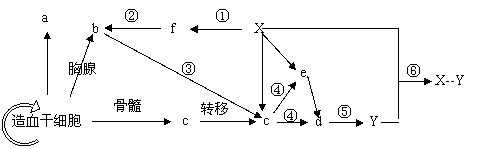 3.下图表示人体内某些淋巴细胞的分化和免疫过程,数字表示过程,字母表示细胞或物质。下列叙述错误的是( )
3.下图表示人体内某些淋巴细胞的分化和免疫过程,数字表示过程,字母表示细胞或物质。下列叙述错误的是( )
A.由造血干细胞形成的a、b、c细胞内蛋白质的种类有所不同
B.①②③过程都需要细胞膜上糖被的参与
C.④⑤过程属于体液免疫的的反应阶段,⑥过程属于效应阶段
D.Y主要在内环境中发挥作用,与Y合成和分泌有关的膜性细胞器有内质网、高尔基体和线粒体
4.在控制条件下将生态和生理情况十分相似的两种农作物(甲和乙)混种在一起,对实验数据统计处理后,得到如下图结果,预测当播种比例为甲:乙=5:5时,种群竞争能力将表现出的趋势是 ( )
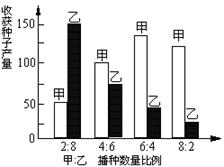
A、甲、乙均增 B、乙强甲弱 C、甲强乙弱 D、甲、乙均减弱
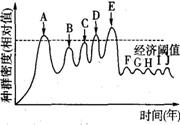 5.右图表示某农田生态系统在实施害虫防治过程中,害虫种群密度变化情况示意图(经济阈值是指害虫种群密度影响农田经济效益的最低值)。在A、B、C、D点进行了农药防治,在E点引入了天敌进行生物防治。下列有关叙述正确的是 ( )
5.右图表示某农田生态系统在实施害虫防治过程中,害虫种群密度变化情况示意图(经济阈值是指害虫种群密度影响农田经济效益的最低值)。在A、B、C、D点进行了农药防治,在E点引入了天敌进行生物防治。下列有关叙述正确的是 ( )
A.在A~D过程中,农药的作用使害虫产生了抗药性突变
B.一般认为农田害虫防治就是控制并完全消灭害虫
C.在F、G、H、I、J点,还必须引入天敌才能控制虫害
D.常利用生物的种间关系在E点进行生物防治
6.1919年,科学家第一次实现了人类多年的幻想——人工转变元素。这个核反应如下:
![]()
![]() +
+![]()
![]() +
+![]()
下列叙述正确的是
A.![]() 原子核内有9个质子 B.
原子核内有9个质子 B.![]() 原子核内有1个中子
原子核内有1个中子
C.O2和O3互为同位素 D.通常情况下,He等稀有气体化学性质都很稳定
7.以下各物质间的每步转化不能通过一步反应就实现的是
A.C→ CO→ CO2 → Na2CO3 B.Fe → Fe3O4 → Fe(OH)3→ FeCl3
C.Na → Na2O2→ Na2CO3→ NaOH D.N2 → NO → NO2→ HNO3
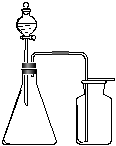 8.利用下列各组中的物质制备并收集少量相应的气体,能采用右图装置的是
8.利用下列各组中的物质制备并收集少量相应的气体,能采用右图装置的是
①浓氨水和固体NaOH制NH3 ②大理石和浓盐酸制CO2
③过氧化氢溶液和二氧化锰制O2 ④稀硝酸和铜片制NO
⑤浓盐酸和二氧化锰制Cl2 ⑥电石与水制C2H2
⑦锌粒和稀硫酸制H2 ⑧乙醇和浓硫酸制C2H4
A.②③ B.①⑥⑦
C.②⑤⑧ D.①④⑥
9.将同浓度、等体积的AgNO3、NaCl、K2SO4三种溶液,同时倒入使用惰性电极的电解槽中,充分混合后,通电片刻,则氧化产物与还原产物的质量比为
A.35.5:108 B.16:137 C.8:1 D.108:35.5
10.有机物甲可氧化生成羧酸,也可还原生成醇。由甲生成的羧酸和醇在一定条件下,可以
生成化合物乙,其分子式为C2H4O2。下列叙述中不正确的是
A.甲分子中碳的质量分数为 40% B.乙比甲的沸点高
C.乙和甲的最简式不相同 D.甲氧化生成的羧酸分子结构中含有醛基
11.下列叙述中不正确的是
A.一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是发生了如下反应:
![]() CH3COO-+ H2O
CH3COOH + OH- 使得溶液中的c(OH-) >
c(H+)
CH3COO-+ H2O
CH3COOH + OH- 使得溶液中的c(OH-) >
c(H+)
B.在0.1 mol/L Na2CO3溶液中:2c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-)
C.在0.1 mol/L NH4Cl溶液中:c(H+) + c(NH4+)=c(Cl-)+c(OH-)
D.将0.2mol/L的盐酸与0.1mol/L的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH—)<c(H+)<c(Al3+)<c(Na+)<c(Cl—)
12.合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
|
在673K、30Mpa下n(NH3)和n(H2)
随时间变化的关系如图所示。下列叙述
正确的是
A.点c处反应达到平衡
B.点a的正反应速率比点b的大
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值小
13.现有等体积的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V
V
A.若混合前三溶液物质的量浓度相等,混合后溶液呈中性,则V1>V2>V3
B.若混合前三溶液pH相等,酸碱恰好完全反应,则V1>V2>V3
C.若混合前三溶液物质的量浓度相等,酸碱恰好完全反应,则V1>V2>V3
D.若混合前三溶液pH相等,将它们同等倍数稀释后,则NaOH溶液pH最大
14.在地球大气层外有很多太空垃圾绕地球转动,可视为绕地球做匀速圆周运动。每到太阳活动期,由于受太阳的影响,地球大气层的厚度增加,从而使得某些太空垃圾进入稀薄大气层,运动半径开始逐渐变小,但每一周仍可视为匀速圆周运动。若在这个过程中某块太空垃圾质量能保持不变,则这块太空垃圾的 ( )
A.线速度逐渐变小 B.加速度逐渐变小
C.运动周期逐渐变小 D.机械能逐渐变大
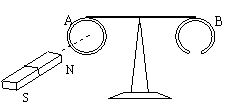 15.如图所示,一绝缘细杆的两端吊着 A、B都是很轻的铝环,分别调在绝缘细杆的两端,杆可绕中间竖直轴在水平面内转动,环A是闭合的,环B是断开的。若用磁铁分别接近这两个圆环,则下面说法正确的是
15.如图所示,一绝缘细杆的两端吊着 A、B都是很轻的铝环,分别调在绝缘细杆的两端,杆可绕中间竖直轴在水平面内转动,环A是闭合的,环B是断开的。若用磁铁分别接近这两个圆环,则下面说法正确的是
A. 图中磁铁N极接近A环时,A环被吸引,而
后被推开
B. 图中磁铁N极远离A环时,A环被排斥,
而后随磁铁运动
C.用磁铁N极接近B环时,B环被推斥,远离磁铁
运动
D.用磁铁的任意一磁极接近A环时,A环均被排斥,环运动方向和磁铁移动方向相同
|
A.在ab棒匀速运动且ab棒上的电流已达到稳定后,
IR≠0,IL≠0,IC=0
B.在ab棒匀速运动且ab棒上的电流已达到稳定后,
IR=0,IL=0,IC=0
C.若ab棒在某一中心位置附近做简谐运动,则
IR≠0,IL≠0,IC≠0
D.若ab棒匀加速运动,则IR≠0,IL≠0,IC=0
17.在平静的水面上激起一列水波,使水面上漂浮的小树叶在3.0s内全振动了6次。当某小树叶开始第6次振动时,沿水波的传播方向与该小树叶相距1.0m、浮在水面的另一小树叶刚好开始振动,则 ( )
A.此水波的周期为2.0s B.此水波的波长为![]() m
m
C.此水波的传播速度为0.40m/s
D.若振动的频率变大,则同样条件下波传播到1.0m远的小树叶处所用的时间将变短
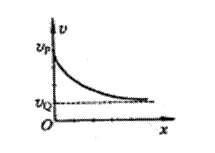 18.P、Q是某电场中一条电场线上的两点,一点电荷仅在电场力作用下,沿电场线从P点运动到Q点,过此两点时的速度大小分别为
18.P、Q是某电场中一条电场线上的两点,一点电荷仅在电场力作用下,沿电场线从P点运动到Q点,过此两点时的速度大小分别为![]() 和
和![]() ,其速度
,其速度![]() 随位移x变化的图象如图5所示。P、Q两点电场强度的大小分别为EP和EQ,该点电荷在这两点的电势能分别为
随位移x变化的图象如图5所示。P、Q两点电场强度的大小分别为EP和EQ,该点电荷在这两点的电势能分别为![]() 。下列判断正确的是( )
。下列判断正确的是( )
A.EP>EQ,![]() B.EP>EQ,
B.EP>EQ,![]()
C.EP<EQ,![]() D.EP<EQ,
D.EP<EQ,![]()
19.现在高速公路上的标志牌都用“回归反光膜”制成,夜间行车时,它能把车灯射出的光 逆向返回,标志牌上的字特别醒目。这种“回归反光膜”是用球体反射原件制成的,如图所示,反光膜内均匀分布着直径为10µm的细玻璃珠,所用玻璃的折射率为
逆向返回,标志牌上的字特别醒目。这种“回归反光膜”是用球体反射原件制成的,如图所示,反光膜内均匀分布着直径为10µm的细玻璃珠,所用玻璃的折射率为![]() ,为使入射的车灯光线经玻璃珠折射→反射→再折射后恰好和入射光线平行,则第一次入射时的入射角应是
,为使入射的车灯光线经玻璃珠折射→反射→再折射后恰好和入射光线平行,则第一次入射时的入射角应是
A.15° B.30°
C.45° D.60°
20.一个带正电的小球自由下落一段时间后,进入一个水平向右的匀强电场,场强大小为E= mg/q,则下列四个图中,能正确表示小球在电场中运动轨迹的是
O x O x O x O x
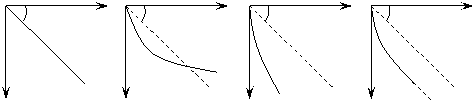 45˚
45˚
45˚
45˚
45˚
45˚
45˚
45˚
y y y y
A B C D
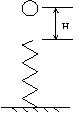 21.如图所示,一小球从轻质弹簧的上方H高处自由下落,接触弹簧后将弹簧压缩,在压缩的全过程中(在弹性限度内且忽略空气阻力)以下说法正确的是
21.如图所示,一小球从轻质弹簧的上方H高处自由下落,接触弹簧后将弹簧压缩,在压缩的全过程中(在弹性限度内且忽略空气阻力)以下说法正确的是
A.球所受弹力的最大值一定大于二倍的重力值
B.球的加速度的最大值一定大于二倍的重力加速度值
C.球刚接触弹簧上端时动能最大
D.球的加速度为零时重力势能与弹性势能之和最大
第II卷(非选择题 共174分)
22.(18分)
(1)有一根横截面为正方形的薄壁管(如图6所示),用游标为20分度的游标卡尺测量其外部边长![]() 的情况如图7甲所示;用螺旋测微器测其管壁厚度d的情况如图7乙所示。则此管外部边长的测量值为
的情况如图7甲所示;用螺旋测微器测其管壁厚度d的情况如图7乙所示。则此管外部边长的测量值为![]() = cm;管壁厚度的测量值为d= mm。
= cm;管壁厚度的测量值为d= mm。
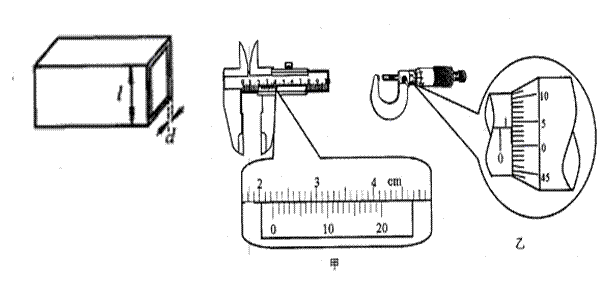
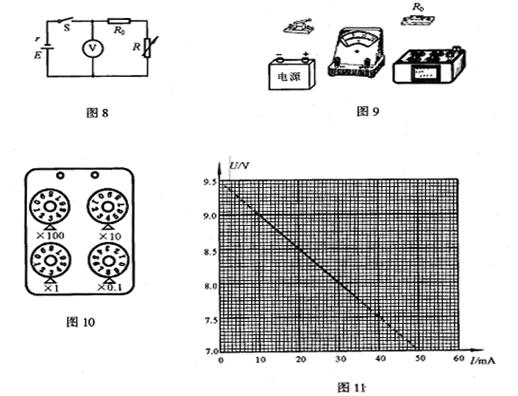
(2)一种电池标称电动势为9V,内电阻约为50Ω,允许的最大输出电流为50mA。为了较准确的测量这个电池的电动势和内电阻,可以设计出如图8所示的实验电路,已知实验中所使用的电压表内电阻足够大,可以忽略其对电路的影响;图中R为电阻箱,阻值范围为0—999.9Ω,R0为保护电阻。
①实验室里备用的定值电阻有以下几种规格: A.10Ω B.50Ω C.150Ω D.500Ω
实验时,R0应选用 较好(填字母代号)。
②按照图8所示的电路图,将图9所示的实物连接成实验电路。
③在实验中,当变阻箱调到图10所示位置后,闭合开关S,电压表的示数为8.70V,此时通过电阻箱的电流为 mA。
④断开开关S,调整电阻箱的阻值,再闭合开关S,读取并记录电压表的示数。多次重复上述操作,可得到多组电压值U和所对应的通过电阻箱的电流值I,利用多次读取和计算出的数据,作出如图11所示的图线。根据图线可知,该电池的电动势E= V,
内电阻r= Ω。
|
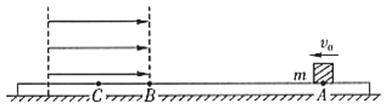
23. (16分)如图所示,在固定的水平的绝缘平板上有A、B、C三点,B点左侧的空间存在着场强大小为E,方向水平向右的匀强电场,在A点放置一个质量为m,带正电的小物块,物块与平板之间的摩擦系数为![]() 。给物块一个水平向左的初速度
。给物块一个水平向左的初速度![]() 之后,该物块能够到达C点并立即折回,最后又回到A点静止下来,求:
之后,该物块能够到达C点并立即折回,最后又回到A点静止下来,求:
(1)此过程中物块所走的总路程s有多大?
(2)若![]() ,那么物块第一次到达B点时的速度
,那么物块第一次到达B点时的速度![]() 是多大?
是多大?
(3)若![]() ,那么物块所带的电量q是多大?
,那么物块所带的电量q是多大?
24.(18分) 如图所示,在虚线左右两侧均有磁感应强度相同的垂直纸面向外的匀强磁场和场强大小相等方向不同的匀强电场,虚线左侧电场方向水平向右,虚线右侧电场方向竖直向上。左侧电场中有一根足够长的固定细杆MN,N端位于两电场的交界线上。a、b是两个质量相同的小环(环的半径略大于杆的半径),a环带电,b环不带电,b环套在杆上的N端且处于静止,将a环套在杆上的M端由静止释放,a环先加速后匀速运动到N端,a环与b环在N端碰撞并粘在一起,随即进入右侧场区做半径为 r =
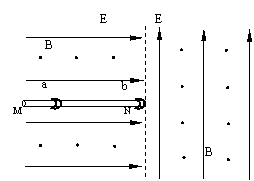 (1)P点的位置;
(1)P点的位置;
(2)a环在杆上运动的最大速率。
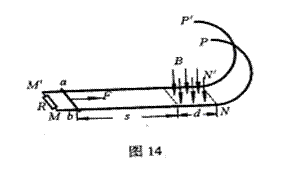 25.(20分)如图14所示,两根正对的平行金属直轨道MN、M′N′位于同一水平面上,两轨道之间的距离
25.(20分)如图14所示,两根正对的平行金属直轨道MN、M′N′位于同一水平面上,两轨道之间的距离![]() =0.50m。轨道的MN′端之间接一阻值R=0.40Ω的定值电阻, NN′端与两条位于竖直面内的半圆形光滑金属轨道NP、N′P′平滑连接,两半圆轨道的半径均为R0=0.5m。直轨道的右端处于竖直向下、磁感应强度B=0.64T的匀强磁场中,磁场区域的宽度d=0.80m,且其右边界与NN′重合。现有一质量m=0.20kg、电阻 r=0.10Ω的导体杆ab静止在距磁场的左边界s=2.0m处。在与杆垂直的水平恒力F=2.0N的作用下ab杆开始运动,当运动至磁场的左边界时撤去F,结果导体杆ab恰好能以最小速度通过半圆形轨道的最高点PP′。已知导体杆ab在运动过程中与轨道接触良好,且始终与轨道垂直,导体杆ab与直轨道之间的动摩擦因数
=0.50m。轨道的MN′端之间接一阻值R=0.40Ω的定值电阻, NN′端与两条位于竖直面内的半圆形光滑金属轨道NP、N′P′平滑连接,两半圆轨道的半径均为R0=0.5m。直轨道的右端处于竖直向下、磁感应强度B=0.64T的匀强磁场中,磁场区域的宽度d=0.80m,且其右边界与NN′重合。现有一质量m=0.20kg、电阻 r=0.10Ω的导体杆ab静止在距磁场的左边界s=2.0m处。在与杆垂直的水平恒力F=2.0N的作用下ab杆开始运动,当运动至磁场的左边界时撤去F,结果导体杆ab恰好能以最小速度通过半圆形轨道的最高点PP′。已知导体杆ab在运动过程中与轨道接触良好,且始终与轨道垂直,导体杆ab与直轨道之间的动摩擦因数![]() =0.10,轨道的电阻可忽略不计,取g=10m/s2,求:
=0.10,轨道的电阻可忽略不计,取g=10m/s2,求:
(1)导体杆刚进入磁场时,通过导体杆上的电流大小和方向;
(2)导体杆穿过磁场的过程中通过电阻R上的电荷量;
(3)导体杆穿过磁场的过程中整个电路产生的焦耳热。
26. (15分)随着人民生活水平的提高,食品安全问题倍受社会关注。苯甲酸(![]() )是一种比较安全的食品防腐剂。
)是一种比较安全的食品防腐剂。
(1)苯甲酸的结构简式为:_____________
(2)由于苯甲酸在常温下微溶于水,通常食品中加入苯甲酸钠。已知苯甲酸钠水溶液pH>7,原因是(用化学方程式表示)
__________________________________________________________________________
(3)尼泊金酯是一种比苯甲酸更安全的食品防腐剂。在浓硫酸加热条件下,对羟基苯甲酸和乙醇混合反应生成尼泊金酯。该反应的化学方程式是
__________________________________________________________________________
(4)A是尼泊金酯的一种同分异构体。已知:
①A能与新制的![]() 浊液反应(加热),产生红色沉淀,生成有机物B;
浊液反应(加热),产生红色沉淀,生成有机物B;
②1mol A最多能与1mol NaOH反应;
③A分子的苯环上有两个相邻的取代基,且由碳原子构成的侧链无支链。
A的结构简式是:__________________________
(5)有机物B在一定条件下能发生消去反应生成桂皮酸,化学方程式为:
_________________________________________________________________
(6)桂皮酸在一定条件下可生成香豆素(![]() )。
)。
该反应的类型是_______________________________________
香豆素的结构简式为:_______________________________________
27.(14分)X、Y、Z为原子序数由小到大排列的三种短周期元素。已知:X、Y的气态氢化物分子具有相同的电数;Y与Z同主族;XY2是非极性分子,其晶体可用作人工降雨。
请回答:
(1)Z的最高价氧化物对应水化物W是重要的化工原料。W的化学式为 ;
工业制造W的生产过程主要分为三个阶段。
①D 101kPa时,3.2g Z的固体单质完全燃烧可放出29.7kJ的热量,写出能够表示该固体单质燃烧热的热化学方程式 ;
②在接触氧化阶段,为提高ZY2的转化率,从理论上判断,应选择的条件是低温和高压。从下表给出不同温度、压强下ZY2平衡转化率的实验数据进行分析,结合工业生产的实际,应选择适合的温度和压强是(选填字母) ;
A.400℃~500℃ 10 MPa B.400℃~500℃ 1 MPa
C.500℃~500℃ 10 MPa D.400℃~500℃ 0.1 MPa
|
转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
③在吸收阶段,为尽可能提高ZY3的吸收效率,工业上选择的吸收剂是(选填字母)
。
A.水 B.0.5mol/L的硫酸 C.98.3%的硫酸 D.浓氨水
(2)已知X与XY都是工业上常用的还原剂。
①写出X单质与W的浓溶液反应的化学方程式 ;
②500℃,11.2 L(标准状况)ZY2在催化剂作用下与XY发生化学反应。若有2×6.02×1023个电子转移时,该反应的化学方程式是 。
28.(14分)镁、铝、铁是重要的金属,在工业生产中用途广泛。
(1)镁与稀硫酸反应的离子方程式为 ;
(2)铝与氧化铁发生铝热反应的化学方程式为 ;
(3)在潮湿的空气里,钢铁表面有一层水膜,很容易发生电化学腐蚀。其中正极的电极反应为 ;
(4)在海洋工程上,通常用铝合金(Al—Zn—Cd)
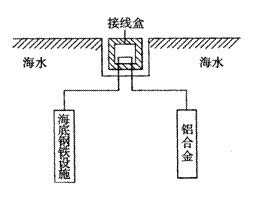 保护海底钢铁设施,其原理如图18所示:
保护海底钢铁设施,其原理如图18所示:
其中负极发生的电极反应为
;
在实际应用中,用铝合金而不选用纯铝。
纯铝不能很好地起到保护作用,其原因是
。
(5)将11.9g Mg—Al—Fe组成的合金溶于足量NaOH溶液中,合金质量减少2.7g。另取等质量的合金溶于过量的稀硝酸中,生成6.72L(标准状况)NO,向反应后的溶液中加入适量的NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为 g
29.(17分)已知:
| 名称 | 化学式 | 颜色、状态 | 溶解性(g) | 熔点(℃) | 密度(g/cm3) |
| 乙二酸 | H | — | 8.6(20℃) | 189.5 | 1.900 |
| 二水合乙二酸 | H | 无色晶体 | — | 101.5 | 1.650 |
注:乙二酸( HOOC—COOH)俗称草酸,带2个结晶水的乙二酸俗称草酸晶体,草酸晶体失去结晶水得无水草酸,在约157℃时升华,其盐草酸钙和草酸氢钙均为白色不溶物。
根据上述信息,回答下列问题。
(1)向盛有Na2CO3粉末的试管里加入约3mL乙二酸溶液,观察到的现象是 ,说明乙二酸的酸性比碳酸 (填“强”或“弱”)。
(2)向盛有5mL乙二酸饱和溶液的试管里滴入3滴用硫酸酸化的0.5%(质量分数)的高锰酸钾溶液,振荡,观察到的现象为 ,说明乙二酸
有 性。
(3)向A试管中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙二酸,按下图甲连接好装置,加热3—5min,在B管中有油状且带有香味的液体产生,该现象说明发生
了 反应(填有机反应类型)。在B试管中加入饱和Na2CO3溶液的目的是
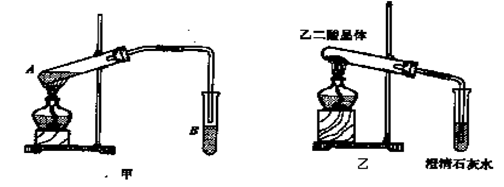 ,导管在液面上的原因是 。
,导管在液面上的原因是 。
(4)已知草酸分解的化学方程式为:![]() ,
,
用图乙装置加热草酸晶体,验证草酸受热分解及其产物,但有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,分析不合理原因 (从下列序号中选择)。
a.草酸晶体的熔点低,未分解之前就已融化并流到试管口,不利于化学反应的进行及实验现象的观察
b.因为加热的是草酸晶体,所以该装置最多只能检验一种分解产物,不能检验是否还有其他分解产物
c.在未洗气的情况下通入石灰水,还可能因草酸蒸气与石灰水反应生成草酸钙沉淀,对实验有干扰
(5)该装置也不符合绿色化学的要求,试说明原因 。
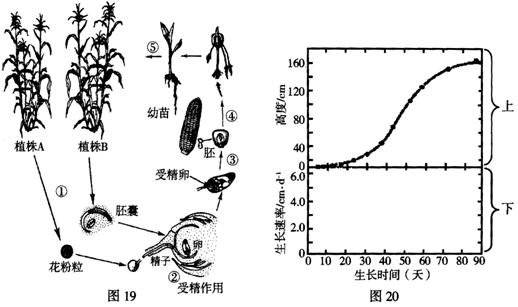
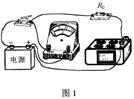
30.(21分)玉米为常见的粮食作物,图19是玉米有性生殖及个体发育过程示意图,请结合下图回答有关问题:
(1)在图19中,维持玉米前后代体细胞染色体数目恒定的两个重要生理过程是
和 。玉米个体发育过程是指图中 (此空用序号表示)。
(2)玉米种子的胚是由 发育而成。玉米种子萌发过程中,不断消耗储存在 中的营养物质,因此, 等酶的活性较强。出土的玉米胚芽鞘直立向上生长主要与 的调节作用有关。
(3)在玉米的个体发育过程中,其株高与生长时间的关系如图20(上)所示。请在图中空白处(下)绘出生长速率和生长时间的关系曲线图。
(4)若想提高农田中玉米的光能利用率,可采取的措施有
(至少答出2点)。
|
31.(21分)酶是由活细胞产生的一类具有生物催化作用的有机物,生物体内的化学反应,基本上都是在酶的催化下进行的。请根据下列有关酶促反应的实验操作,回答相关问题。
| 实验操作 | 试 管 | |||||
| A | B | C | D | E | F | |
| 1.加入质量分数为1%的可溶性淀粉溶液1 mL | + | + | - | - | + | - |
| 2.加入质量分数为2%的蔗糖溶液1 mL | - | - | + | + | - | + |
| 3.加入唾液淀粉酶原液1 mL | + | - | + | - | - | - |
| 4.加入蔗糖酶溶液1 mL | - | + | - | + | - | - |
| 5.加入蒸馏水1 mL | - | - | - | - | + | + |
| 6.酶促水解反应 | 摇匀,37℃水浴中保温10min | |||||
| 7.向每个试管中加入斐林试剂2 mL | 摇匀,沸水浴中加热1~2min | |||||
| 8.观察并记录各试管内的变化 | ||||||
注:表中“+”为加入,“-”为未加入
(1)本实验的变量是 。
(2)制备淀粉溶液时需加热煮沸,但制备好以后必须冷却到室温才能使用,这是防止
。
(3)上述实验中, 号试管能与斐林试剂发生反应生成砖红色沉淀,本实验的结论为 。
(4)实验过程中,E、F号试管起 作用。如果E、F号试管也出现砖红色沉淀,可能有很多原因,下列分析正确的是(用序号表示) 。
①淀粉溶液、蔗糖溶液不纯,混有还原性糖
②淀粉溶液、蔗糖溶液放置的时间太长,其中的微生物将部分淀粉、蔗糖分解成还原性糖
③试管不干净、上面留有还原性糖
④实验操作过程中,胶头滴管混用、错用
(5)如果条件所限,只保留两支试管,也能初步得出实验结论,请你写出可能的组合
。
(6)本实验,能否用碘液代替斐林试剂 (能/不能)。理由是
。
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 选项 | B | D | C | C | D | D | B | A | C | C | B |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | |
| 选项 | B | A | C | D | A | C | A | D | C | A |
北京市部分重点高中4月
一、选择题
二非选题
|
(1)2.230—2.240…………………………(3分)
1.037—1.039………………………………(3分)
(2)①C………………………………(3分)
②如图1所示………………………………(2分)
③17.6(17—18均可得分)………………………(2分)
④9.45—9.55(9.5也可得分)………………………………(2分)
50.0(50也同样得分)
23. (16分)
解:(1)对全程应用动能定理有:
![]() ……………………………………① (4分)
……………………………………① (4分)
![]() …………………………………………(2分)
…………………………………………(2分)
(2)对![]() 段应用动能定理有:
段应用动能定理有:
![]() ……………………………………② (4分)
……………………………………② (4分)
![]() …………………………………………(2分)
…………………………………………(2分)
(3)对A→C过程应用动能定理有:
![]() ………………………………③(4分)
………………………………③(4分)
∴![]() ……………………………………………………(2分)
……………………………………………………(2分)
24.(18分)
(1)因为a环由静止释放后向右运动,所以a环带正电,a环与b环碰后仍带正电,又因碰后速度水平向右,所以两环运动半个圆周后到达P点,据左手定则可判断P点在N点的正下方,NP = 2r =
(2)设a环质量为m,电荷量为q,由受力分析可知,a环在杆上速率达到最大时做匀速运动,有 qE = μFN 即 qE = μ(mg+qvmaxB) ……①
碰撞时动量守恒 mvmax = 2mv' ……②
由于碰后两环在右侧场区做匀速圆周运动
所以重力与电场力平衡 qE = 2mg ……③
洛仑兹力提供向心力 q v'B =![]() ……④
……④
①②③④联立解得: vmax =![]() =
=
25.(20分)(1)设导体杆在F的作用下运动至磁场的左边界时的速度为![]() ,根据动能定理则有
,根据动能定理则有![]() …………………………………………………………(2分)
…………………………………………………………(2分)
导体杆刚进入磁场时产生的感应电动势![]() ………………………………(1分)
………………………………(1分)
此时通过导体杆的电流大小![]() A(或
A(或
根据右手定则可知,电流方向为由b向a…………………………………………(2分)
(2)设导体杆在磁场中运动的时间为t,产生的感应电动势的平均值为E平均,则由法拉第电磁感应定律有![]() …………………………………………(2分)
…………………………………………(2分)
通过电阻R的感应电流的平均值为![]() …………………………(1分)
…………………………(1分)
通过电阻R的电荷量![]() C(或
C(或
(3)设导体杆离开磁场时的速度大小为![]() ,运动到圆轨道最高点的速度为
,运动到圆轨道最高点的速度为![]() ,因导体杆恰好能以最小速度通过半圆形轨道的最高点,根据牛顿第二定律对导体杆的轨道最高点时有
,因导体杆恰好能以最小速度通过半圆形轨道的最高点,根据牛顿第二定律对导体杆的轨道最高点时有![]() ………………………………………………………………(1分)
………………………………………………………………(1分)
对于导体杆从![]() 的过程,根据机械能守恒定律有
的过程,根据机械能守恒定律有
![]() …………………………………………………………(1分)
…………………………………………………………(1分)
解得![]() =
=
导体杆穿过磁场的过程中损失的机械能![]() …………(3分)
…………(3分)
此过程中电路中产生的焦耳热为![]() ……………………(2分)
……………………(2分)
26. (15分)
(1)![]() ……………………………………………(2分)
……………………………………………(2分)
(2)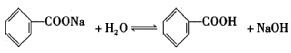 ………………………(2分)
………………………(2分)
(3)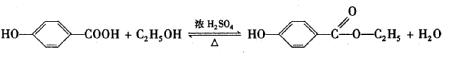
……………………………………………(3分)
(4)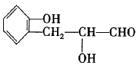 ……………………………………………(2分)
……………………………………………(2分)
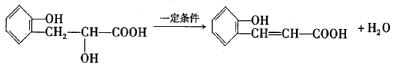
(5)
……………………………………………(3分)
(6)酯化反应(1分);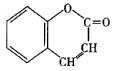 ……………………………………(2分)
……………………………………(2分)
27.(14分)
(1)H2SO4………………………………………………………………………………(2分)
①S(s)+O2(g) SO2(g);△H=-297kJ/mol(有“点燃”条件给分)………(3分)
②D………………………………………………………………………………………(2分)
|
|
②SO2+2CO S+2CO2……………………………………………………………(3分)
|
(2)2Al+Fe2O3 AlO2O3+2Fe………………………………………………………(2分)
(3)2H2O+O2+4e- 4OH-…………………………………………………………(2分)
(4)Al-3e- Al3+……………………………………………………………………(2分)
铝表面易被氧化,生成一层致密而坚固的氧化物薄膜,阻止金属继续氧化,使金属具有抗腐蚀性能。…………………………………………………………………………(3分)
(5)27.2………………………………………………………………………………(3分)
29.(17分) (1)有无色气泡产生 (2分) 强 (1分)
(2)高锰酸钾溶液紫色褪去 (2分) 还原(2分)
(3)酯化(取代)(1分)吸收乙醇,除去乙酸,降低乙酸乙酯溶解度,并有利于分层
(3分)(答出其中一点且叙述合理得1分) 防止倒吸(或防止B中液体倒吸至A中)(1分)
(4)a、b、c(3分)
(5)产生的CO有毒,未经处理、吸收,会污染空气(2分)(其他合理答案均给分)
|
30.(21分)
(1)减数分裂……………………(2分)
受精作用……………………(2分)
③④⑤………………………(2分)
注:不全不得分。
(2)受精卵…………………………(2分)
胚乳…………………………………(2分)
淀粉酶………………………………(2分)
生长素………………………………(2分)
注:填激素不得分。
(3)见图3…………………………(3分)
注:只要与标答图形相似,即可得分。
(4)套种、合理密植、合理施肥、良好通风 合理灌溉 中耕松土………………(4分)
注:要求答出2点,合理得分。不是具体措施,不得分。
31.(21分)(1)酶的种类(淀粉酶、蔗糖酶)………(2分)
(2)温度过高破坏酶的活性…………………………(2分)
(3)A、D………………………………………………(2分)
注:不全不得分。
酶具有专一性…………………………………………(2分)
(4)(空白)对照……………………………………(2分)
①②③④……………………………………………(2分)
注:不全不得分。
(5)AB CD AC BD ………………………(4分)
注:不全不得分。
(6)不能……………………………………………………(2分)
碘液不能检测蔗糖是否被分解产生还原性糖(蔗糖不与碘液发生显色反应,蔗糖水解产物也不与碘液发生显色反应)…………………………………………(3分)
 压强/MPa
压强/MPa