第一章综合测试题
一、选择题(30′)
1.某元素在化学反应中,由化合态变为游离态,则该元素( )
A.一定被氧化了 B.一定被还原了
C.既可能被氧化又可能被还原 D.既未被氧化也未被还原
2.已知2KClO3+I2![]() 2KIO3+Cl2,下列对于此反应的叙述中正确的是( )
2KIO3+Cl2,下列对于此反应的叙述中正确的是( )
A.Cl2是氧化剂,I2是还原剂 B.该反应是置换反应
C.还原性I2>Cl2 D.氧化性KIO3>KClO3
3.对于反应CaH2+2H2O![]() Ca(OH)2+2H2↑,有下列判断:①H2只是氧化产物;②H2只是还原产物;③H2O是氧化剂;④CaH2是还原剂;⑤氧化产物与还原产物的分子数之比为1∶1.其中正确的是( )
Ca(OH)2+2H2↑,有下列判断:①H2只是氧化产物;②H2只是还原产物;③H2O是氧化剂;④CaH2是还原剂;⑤氧化产物与还原产物的分子数之比为1∶1.其中正确的是( )
A.①② B.③ C.③④ D.③④⑤
4.电解质在溶液中电离时,一定相等的是( )
A.每个阴、阳离子所带的核电荷数
B.阴、阳离子的个数
C.阴、阳离子所带的电荷总数
D.阴、阳离子的总数
5.下列反应均可在溶液中进行,能用同一离子方程式表示的是( )
A.NaHCO3、BaCO3分别与盐酸作用
B.Ba(OH)2、Ba(NO3)2分别与稀H2SO4反应
C.Ca(NO3)2、CaCl2分别与Na2CO3、K2CO3反应
D.Na2S、(NH4)2S分别与盐酸反应
6.下列离子方程式书写正确的是( )
A.氢氧化钠和稀硫酸:H++OH-=H2O
B.铁和稀硫酸:Fe+2H+=Fe3++H2↑
C.氢氧化钡和稀硫酸:H++OH-=H2O
D.碳酸钠和稀盐酸:CO32-+2H+=H2O+CO2↑
7.在酸性无色透明溶液中不能大量共存的离子组是( )
A.Al3+、Ag+、NO3-、Cl- B.Mg2+、NH4+、NO3-、Cl-
C.Ba2+、K+、S2-、Cl- D.Zn2+、Na+、NO3-、SO42-
8.在强酸性溶液中可发生如下反应:2Mn2++5R2O8x-+8H2O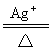 16H++10RO42-+2MnO4-,这个反应可定性地检验Mn2+的存在.在反应中充当氧化剂的R2O8x-中x的值是( )
16H++10RO42-+2MnO4-,这个反应可定性地检验Mn2+的存在.在反应中充当氧化剂的R2O8x-中x的值是( )
A.0 B.1 C.2 D.3
9.xR2++yH++O2=mR3++nH2O的离子方程式中,对m和R3+判断正确的是( )
A.m=4,R3+是氧化产物 B.m=y,R3+是氧化产物
C.m=2,R3+是还原产物 D.m=y/2,R3+是还原产物
10.海湾战争期间,科威特大批油井被炸着火,下列措施不能考虑灭火的是( )
A.设法阻止石油喷射 B.设法降低火焰温度
C.设法使火焰隔绝空气 D.设法降低石油着火点
11.冬天发生煤气中毒是因为煤气中的CO( )
A.是易燃气体 B.具有还原性
 C.它和O2化合生成CO2 D.与血红蛋白结合,造成人体缺氧
C.它和O2化合生成CO2 D.与血红蛋白结合,造成人体缺氧
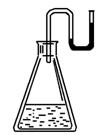
12.有下列物质:①NaOH固体;②浓硫酸;③NH4NO3晶体;④CaO固体.现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内的滴有红墨水的水面呈形如右图所示状态,判断加入的物质可能是 ( )
A.①②③④ B.①②④
C.②③④ D.①②③
13.相同温度和压强下,将32g硫分别于纯氧和空气中点燃完全燃烧,前者放出热量为Q1,后者放出热量为Q2,则关于Q1、Q2的相对大小,正确的判断是( )
A.Q1=Q2 B.Q1>Q2
C.Q1<Q2 D.无法判断
14.燃料充分燃烧的条件是( )
A.有足够多的空气 B.有氧气参加
C.达到着火点 D.与空气有足够大的接触面
15.酸雨的形成主要是由于( )
A.森林遭到乱砍滥伐,破坏了生态平衡
B.工业上大量燃烧含硫燃料
C.汽车排出大量尾气
D.大气中二氧化碳含量增多
二、填空题(30′)
1.各举一例(写出化学方程式),盐酸在反应中
(1)作氧化剂_____________ (2)作还原剂_____________
(3)既不是氧化剂也不是还原剂_____________
2.G、Q、X、Y、Z均为氯的含氧化合物.我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平):
①G→Q+NaCl;
②Q+H2O![]() X+H2;
X+H2;
③Y+NaOH→G+Q+H2O;
④Z+NaOH→Q+X+H2O
这五种化合物中氯的化合价由低到高的顺序为_____________.
3.油画所用颜料含有某种白色铅化合物,置于空气中,天长日久后就会变成黑色PbS,从而使油画的色彩变暗.若用H2O2来“清洗”,则可将PbS转变为白色的PbSO4,从而使油画“复原”.
(1)上述“清洗”反应的化学方程式为____________________________.
(2)在此反应中,H2O2作__________剂,发生转移的电子数目为__________.
4.从数学集合的角度看,四种基本反应类型与氧化还原反应所属的关系为:复分解反应_____________________,置换反应_____________________,化合反应_____________________,分解反应_____________________.
5.下列物质中,属于强电解质的是_____________,属于弱电解质的是_____________,属于非电解质的是_____________.
A.氯化钠 B.硫 酸 C.醋 酸 D.氯化银 E.乙 醇
F.蔗 糖 G.氯化铝 H.三氧化硫 I.铜 J.氨 气
6.处于下列状态的物质中:A.硫酸钡晶体、B.纯硫酸、C.熔融氢氧化钠、D.熔融氧化铝、E.液态三氧化硫、F.酒精、G.石墨、H.铝、I.氯化钠的水溶液
(1)上述物质中能导电的是_____________;
(2)上述物质中属于电解质的是_____________;
(3)上述物质中属于非电解质的是_____________;
(4)上述物质中溶于水后水溶液能导电的是_____________.
7.硫酸氢钠的电离方程式为_____________________,分别写出向硫酸氢钠溶液中加入下列试剂的离子方程式:
(1)碳酸氢钠溶液_____________________;
(2)氢氧化钡溶液(反应后溶液显中性) _____________________;
(3)氢氧化钡溶液(反应后溶液显碱性)______________________________________.
8.有五瓶溶液分别为a、b、c、d、e,它们可能是AgNO3、BaCl2、HCl、K2CO3、K2SO3.现做如下实验:a和b混合;a和c混合;a和d混合;c和d混合;e和d混合;e和a混合,都有白色沉淀生成,b和c混合有无色无味气体生成,则五种溶液是a_____________、b_____________、c_____________、d_____________、e_____________.
9.现有一包固体粉末,其中可能含有CaCO3、Na2CO3、Na2SO4、NaCl、CuSO4.进行如下实验:①溶于水得无色溶液,②向溶液中加BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失,据上述实验现象推断:①一定不存在_____________②一定存在_____________③可能存在_____________④对于可能存在的物质应如何进一步检验?写出简要的步骤和有关的离子方程式.
10.在一个烧杯里,加入20gBa(OH)2·8H2O粉末,将小烧杯放在事先已滴有3~4滴水的玻璃片上.然后加入10gNH4Cl晶体,并用玻璃棒迅速搅拌.
(1)实验中玻璃棒的作用是____________________________.
(2)写出有关反应的方程式:____________________________,该反应属_____________反应.
(3)实验中观察到的现象有_____________、_____________和反应混合物成糊状.反应混合物呈糊状的原因是________________________________________________________.
(4)通过_____________现象,说明该反应为_____________热反应,这是由于反应物的总能量_____________生成物的总能量.
三、问答题(10′)
1.写出下列反应的离子方程式
(1)AgNO3溶液与KCl溶液混合: (2)NaHCO3溶液中加NaHSO4溶液:
____________________________ ____________________________
(3)铁片放入硫酸铜溶液中: (4)硫酸和氢氧化钡溶液混合:
____________________________ ____________________________
(5)大理石放入稀盐酸中: (6)向石灰水中通入过量的CO2气体:
____________________________ ____________________________
2.选择适当的物质完成下列反应,写出有关的化学方程式:
(1)CO2+2OH-=H2O+CO32- (2)Fe3++ =Fe(OH)3↓
____________________________ ____________________________
(3) +Cl-=AgCl↓ (4) +2H+=CO2↑+H2O
____________________________ ____________________________
四、计算题(30′)
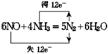
1.化工厂经常用浓氨水检验管道是否漏气,其反应的化学方程式为3Cl2+8NH3![]() 6NH4Cl+N2,当有160.5gNH4Cl产生时,求被氧化的氨气是多少g?
6NH4Cl+N2,当有160.5gNH4Cl产生时,求被氧化的氨气是多少g?
2.向氯化钡溶液中滴加硫酸溶液,反应恰好完全时,溶液的质量保持不变,试求原硫酸溶液的质量分数.
3.在一定条件下发生如下反应:6NO+4NH3=5N2+6H2O.现有10gNO,NH3的混合物充分反应后所得产物中,若经还原得到N2为8.4g.
(1)标出该反应中电子转移的方向和数目,指出氧化剂和还原剂.
(2)若上述反应完全,试计算,原混合物中NO和NH3的质量至少各多少克?
第一章综合测试题参考答案
一、1.C 2.BC 3.D 4.C 5.CD 6.AD 7.AC 8.C 9.AB 10.D 11.D 12.B 13.A 14.AD 15.B
二、1.(1)Fe+2HCl=FeCl2+H2↑ (2)MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑ (3)NaOH+HCl
MnCl2+2H2O+Cl2↑ (3)NaOH+HCl![]() NaCl+H2O
2.G<Y<Q<Z<X 3.(1)PbS+4H2O2
NaCl+H2O
2.G<Y<Q<Z<X 3.(1)PbS+4H2O2![]() PbSO4+4H2O (2)氧化 8
4.相离
真子集 相交 相交 5.ABDG;C;EFHJ 6.(1)CDGHI;(2)ABCD;(3)EF;(4)BCEI 7.NaHSO4
PbSO4+4H2O (2)氧化 8
4.相离
真子集 相交 相交 5.ABDG;C;EFHJ 6.(1)CDGHI;(2)ABCD;(3)EF;(4)BCEI 7.NaHSO4![]() Na++H++SO42- (1)H++HCO3-
Na++H++SO42- (1)H++HCO3-![]() H2O+CO2↑ (2)Ba2++2OH-+SO42-+2H+
H2O+CO2↑ (2)Ba2++2OH-+SO42-+2H+![]() BaSO4↓+2H2O (3)Ba2++OH-+SO42-+H+
BaSO4↓+2H2O (3)Ba2++OH-+SO42-+H+![]() BaSO4↓+H2O 8.a.AgNO3 b.HCl c.K2CO3 d.BaCl2 e.K2SO3
BaSO4↓+H2O 8.a.AgNO3 b.HCl c.K2CO3 d.BaCl2 e.K2SO3
9.①CaCO3、CuSO4、Na2SO4 ②Na2CO3 ③NaCl ④取无色溶液少许放入试管中,滴加足量稀HNO3,待气泡放尽后,加AgNO3试剂,看是否产生白色沉淀,若有,则含有NaCl,反之则无.CO32-+2H+=CO2↑+H2O Ag++Cl=AgCl↓
10.(1)使混合物充分接触并起反应 (2)Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3+10H2O;复分解 (3)玻璃片上结冰而与小烧杯粘结在一起;有少许刺激性气味;反应发生时有水生成. (4)结冰(粘结);吸;小于. 5.(1)电能转变成光能和热能 (2)保护钨丝不被氧化
三、1.(1)Ag++Cl-![]() AgCl↓ (2)HCO3-+H+
AgCl↓ (2)HCO3-+H+![]() H2O+CO2↑ (3)Fe+Cu2+
H2O+CO2↑ (3)Fe+Cu2+![]() Fe2++Cu (4)SO42-+2H++Ba2++2OH-
Fe2++Cu (4)SO42-+2H++Ba2++2OH-![]() BaSO4↓+2H2O (5)CaCO3+2H+
BaSO4↓+2H2O (5)CaCO3+2H+![]() Ca2++CO2↑+H2O (6)OH-+CO2
Ca2++CO2↑+H2O (6)OH-+CO2![]() HCO3- 2.(1)CO2+2NaOH
HCO3- 2.(1)CO2+2NaOH![]() Na2CO3+H2O (2)3OH-;FeCl3+3NaOH
Na2CO3+H2O (2)3OH-;FeCl3+3NaOH![]() Fe(OH)3↓+3NaCl (3)Ag+,AgNO3+KCl
Fe(OH)3↓+3NaCl (3)Ag+,AgNO3+KCl![]() AgCl↓+KNO3 (4)CO32-;Na2CO3+2HCl
AgCl↓+KNO3 (4)CO32-;Na2CO3+2HCl![]() CO2↑+H2O+2NaCl
CO2↑+H2O+2NaCl
 四、1.17g 2.42.1% 3.(1)
四、1.17g 2.42.1% 3.(1)
氧化剂NO,还原剂NH3
(2)NO1.8g、NH38.2g或NO3.2g,NH36.8g