第一章单元测试题
一、选择题(50′)
1.下列反应中,反应物中各种元素都参加氧化还原反应的是( )
A.2KClO3![]() 2KCl+3O2↑
B.CuO+H2
2KCl+3O2↑
B.CuO+H2![]() Cu+H2O
Cu+H2O
C.2AgNO3=2Ag+2NO2↑+O2↑ D.Cl2+H2O=HCl+HClO
2.在MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O的反应中,被氧化的HCl与参加反应的HCl质量关系是( )
MnCl2+Cl2↑+2H2O的反应中,被氧化的HCl与参加反应的HCl质量关系是( )
A.两者质量相等 B.后者是前者的3倍
C.前者是后者的1/2 D.前者是后者的1/4
3.下列酸、碱中和反应中,可以用“H++OH-=H2O”表示的是( )
A.HNO3+KOH B.CH3COOH+NaOH
C.H2SO4+Cu(OH)2 D.HCl+NH3·H2O
4.某学生用托盘天平称量氯酸钾晶体4.6g(1g以下只能用游码),但在操作时将药品和砝码所应放置的位置颠倒了,则称得的氯酸钾晶体的质量实际应是( )
A.3.6g B.5.6g C.4.8g D.3.4g
5.氧化还原反应的实质是( )
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
6.下列关于氧化还原反应实质的说法中,比较确切的是( )
A.有电子转移 B.有电子得失
C.得氧或失氧 D.有元素化合价变化
7.下列哪一个反应表示二氧化硫被还原( )
A.SO2+2H2O+Cl2![]() H2SO4+2HCl
B.SO2+2NaOH
H2SO4+2HCl
B.SO2+2NaOH![]() Na2SO3+H2O
Na2SO3+H2O
C.SO2+2H2S![]() 2H2O+3S
D.SO2+PbO2
2H2O+3S
D.SO2+PbO2![]() PbSO4
PbSO4
8.下列反应中,盐酸作为氧化剂的是( )
A.Zn+2HCl![]() ZnCl2+H2↑
B.FeS+2HCl
ZnCl2+H2↑
B.FeS+2HCl![]() FeCl2+H2S↑
FeCl2+H2S↑
C.NH3+HCl![]() NH4Cl D.MnO2+4HCl
NH4Cl D.MnO2+4HCl![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
9.在化学反应2KClO3 2KCl+3O2中,KClO3所起的作用是( )
2KCl+3O2中,KClO3所起的作用是( )
A.氧化剂 B.还原剂
C.既是氧化剂,又是还原剂 D.既不是氧化剂,又不是还原剂
10.下列化学方程式中电子转移有错误的是( )

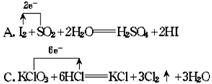
11.下列说法正确的是( )
A.需要加热方能发生的反应一定是吸热反应
B.放热反应在常温下一定很容易发生
C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应在一定条件下也能自发地进行
12.下列物质加入水中显著放热的是( )
A.固体NaOH B.生石灰 C.无水乙醇 D.固体NH4NO3
13.下列离子方程式中,书写正确的是( )
A.稀硫酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑
B.碳酸氢钠溶液与盐酸混合:CO32-+2H+=CO2↑+H2O
C.硫酸铜溶液与氢氧化钡溶液混合:Cu2++2OH-=Cu(OH)2↓
D.碳酸钙溶于硝酸:CaCO3+2H+=Ca2++CO2↑+H2O
14.下列各组中的离子,不能在溶液中大量共存的是( )
A.Na+、NH4+、Cl-、OH- B.H+、Fe3+、SO42-、NO3-
C.Cu2+、Ba2+、Cl-、SO42- D.Na+、Ca2+、NO3-、HCO3-
15.下列反应中,水只作还原剂的是( )
A.CaO+H2O![]() Ca(OH)2
B.C+H2O
Ca(OH)2
B.C+H2O CO+H2
CO+H2
C.2F2+2H2O![]() 4HF+O2↑
D.3NO2+H2O
4HF+O2↑
D.3NO2+H2O![]() 2HNO3+NO
2HNO3+NO
16.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
A.Cu(OH)2和HCl,Cu(OH)2和HAc
B.Ba(OH)2和MgSO4,BaCl2和(NH4)2SO4
C.NaHCO3和NaHSO4,Na2CO3和NaHSO4
D.NaHCO3和(过量)Ca(OH)2,Ca(HCO3)2和NaOH(过量)
17.在反应6KOH+3Cl2=5KCl+KClO3+3H2O中,被氧化的原子和被还原的原子个数比是( )
A.5∶1 B.1∶5 C.1∶1 D.3∶1
18.在4FeS2+11O2![]() 2Fe2O3+8SO2反应中,氧化产物是( )
2Fe2O3+8SO2反应中,氧化产物是( )
A.Fe2O3 B.SO2 C.Fe2O3和SO2 D.都不是
19.3个SO32-离子恰好将2个XO4离子还原,本身被氧化生成3个SO42-离子,则X元素在生成产物中的化合价是( )
A.+1 B.+2 C.+3 D.+4
20.M2O7X-与S2-在酸性溶液中反应如下:
M2O7X-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7X-中M的化合价是( )
A.+2 B.+3 C.+4 D.+6
21.在海湾战争期间,科威特大批油井被炸着火。在灭火工作中,下列措施不能考虑用于灭火的是( )
A.设法阻止石油喷射 B.设法降低火焰温度
C.设法降低石油着火点 D.设法使火焰隔绝空气
22.以下读数方式会造成溶液体积变小的是( )
A.用酸式滴定管放液前俯视读数
B.用酸式滴定管放液前俯视读数,放液后又仰视读数
C.用量筒量液体时仰视读数
D.用容量瓶定容时仰视读数
23.向饱和的石灰水溶液中不断通入二氧化碳,其溶液导电性的变化是( )
A.由弱变强 B.由强变弱
C.由强变弱再变强 D.由弱变强再变弱
24.有由Na2S、Na2SO3、Na2SO4组成的混合物,经测定其中含硫25.6%,则此混合物含氧是( )
A.36.8% B.51.2% C.37.6% D.无法计算
25.已知在溶液中的X2+2Y-![]() Y2+2X-和Y2+2Z-
Y2+2X-和Y2+2Z-![]() 2Y-+Z2反应很完全,则下列判断一定正确的是( )
2Y-+Z2反应很完全,则下列判断一定正确的是( )
A.X-、Y-、Z-氧化性依次减弱
B.Z2与X-可发生反应:Z2+2X-![]() 2Z-+X2
2Z-+X2
C.Z2、Y2、X2氧化性依次增强
D.X-、Y-、Z-失电子能力依次增强
二、填空题(30′)
1.在CuO+H2![]() Cu+H2O反应中,__________元素的化合价升高,该元素的原子__________电子,发生__________反应,是还原剂;__________元素的化合价降低,该元素的原子__________电子,发生__________反应,是氧化剂.
Cu+H2O反应中,__________元素的化合价升高,该元素的原子__________电子,发生__________反应,是还原剂;__________元素的化合价降低,该元素的原子__________电子,发生__________反应,是氧化剂.
2.已知下列反应
①HPO3+H2O![]() H3PO4
H3PO4
②2Na2O2+2H2O![]() 4NaOH+O2↑
4NaOH+O2↑
③2F2+2H2O![]() 4HF+O2
4HF+O2
④2K+2H2O![]() 2KOH+H2↑
2KOH+H2↑
⑤Cl2+H2O![]() HCl+HClO
HCl+HClO
其中,H2O作氧化剂的是__________,H2O作还原剂的是__________,H2O既不是氧化剂,又不是还原剂的是__________,其中不属于氧化还原反应的是__________.
3.现有以下10个化学方程式:
(1)PCl3+Cl2![]() PCl5
PCl5
(2)2Cl2+2Ca(OH)2![]() CaCl2+Ca(ClO)2+2H2O
CaCl2+Ca(ClO)2+2H2O
(3)Ca(ClO)2+H2O+CO2![]() CaCO3↓+2HClO
CaCO3↓+2HClO
(4)MnO2+4HCl![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(5)P2O5+3H2O![]() 2H3PO4
2H3PO4
(6)Zn+CuSO4![]() Cu+ZnSO4
Cu+ZnSO4
(7)H2+Cl2 2HCl
2HCl
(8)2KI+Br2![]() 2KBr+I2
2KBr+I2
(9)2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
(10)3NH3+H3PO4![]() (NH4)3PO4
(NH4)3PO4
A.以上反应是氧化还原反应的是___________,(1)、(2)、(4)中的氧化剂分别是__________、__________、__________.
B.在(6)、(8)的反应中氧化产物分别是__________、__________.
C.在反应(7)、(8)、(9)中有还原性的物质是__________、__________、__________.
D.在反应(1)—(8)中被还原的物质是__________、__________.
4.针对以下A~D四个涉及H2O2的反应(未配平),填空白:
(A)Na2O2+HCl![]() H2O2+NaCl
H2O2+NaCl
(B)Ag2O+H2O2![]() Ag+O2+H2O
Ag+O2+H2O
(C)H2O2![]() H2O+O2
H2O+O2
(D)H2O2+Cr2(SO4)3+KOH![]() K2CrO4+K2SO4+H2O
K2CrO4+K2SO4+H2O
(1)H2O2仅体现氧化性的反应是(填代号)__________,该反应配平的化学方程式为_______________________________.
(2)既体现氧化性又体现还原性的反应是(填代号)_________________.
(3)H2O2体现弱酸性的反应是_______________,其理由为___________________________.
5.下列微粒:①S、②S2-、③Na+、④Fe2+、⑤H+、⑥Cu、⑦O2、⑧HCl、⑨H2O,其中在反应中只能作还原剂的是__________,只能作氧化剂的是___________,既可作还原剂又可作氧化剂的是__________.
6.某固体混合物可能由KNO3、K2SO4、KCl、NaCl、CuCl2和Na2CO3中的一种或几种组成,依次进行如下实验,观察到的实验现象记录如下:
(1)混合物加水得无色透明溶液;
(2)向上述溶液中滴加过量BaCl2溶液,有白色沉淀生成,将该沉淀滤出,此沉淀可完全溶于稀HNO3;
(3)向(2)的滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀HNO3.
据此,可判断出混合物中肯定会有_________,肯定没有_________,可能含有_________.
三、计算题(20′)
1.化工厂经常用浓氨水检验管道是否漏氯气,其反应为3Cl2+8NH3=6NH4Cl+N2,当有160.5gNH4Cl产生时,求被氧化的氨气是多少g?
2.向氯化钡溶液中滴加硫酸溶液,反应恰好完全时,溶液的质量保持不变,试求原硫酸溶液的质量分数.
参考答案
第一章单元测试题
一、1.C 2.C 3.A 4.D 5.C
6.A 7.C 8.A 9.C 10.C 11.CD 12.AB 13.D 14.AC 15.C 16.D 17.B 18.C 19.D 20.D 21.C 22.B 23.C 24.C 25.CD
二、1.氢、失去、氧化、铜、得到、还原
2.④、③、①②⑤、① 3.A:(1)(2)(4)(6)(7)(8)(9) Cl2、Cl2、MnO2 B:ZnSO4、I2 C:H2、KI、KClO3 D:Cl2 Br2
4.(1)D 3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O (2)C (3)A 可视为强酸制弱酸的反应 5.②⑥;③⑤⑦;①④⑧⑨
6.Na2CO3;CuCl2、K2SO4;KNO3、KCl、NaCl.
三、1.17g 2.42.1%