湖北省部分重点中学2006届高三第一次联考
理 综 试 卷
命题人:吴安、刘大波、朱虹 2005年11月17日 下午:3:00-5:30
本试卷分为I卷(选择题)和第II卷(非选择题)两部分,满分300分,考试时间150分钟。
注意事项
1、请考生务必将自己的姓名、准考证号填写在答题卡指定地点,同时请阅读答题卡上的注意事项。
2、所有题目答案答在答题卡上。答第I卷时,每小题选出答案后,用2B铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案。答第II卷时,直接用0.5mm签字笔在答题卡指定区域作答。
3、考试结束,监考人员将试题和答题卡一并收回。
4、以下数据可供解题时参考:C—12,O—16,S—32,Fe—56,Ca—40,Cu—64
第I卷(选择题,共126分)
一、选择题(本题包括13小题。每小题只有一个选项符合题意)。
1. 将用3H标记的尿苷引入某类植物细胞内,然后设法获得各种结构,其中均能表现放射性的一组结构是:
A. 细胞核、核仁和中心体 B. 细胞核、核糖体和高尔基体
C. 细胞核、核糖体、线粒体和叶绿体 D. 细胞核、核糖体、内质网和液泡
2. 英国科学家斯勒和米尔坦斯,将B淋巴细胞产生抗体的基因转移到肿瘤细胞内,成功获得世界上第二株能稳定分泌单一抗体的杂交瘤细胞株,肿瘤细胞增的生方式和产物是:
A. 无丝分裂和逆转录抗体 B. 减数分裂和转基因抗体
C. 有丝分裂和单克隆抗体 D. 减数分裂和单克隆抗体
 |
3. 右侧图像不能表达的生物学意义是:
A. 在一定范围内,植物光合速率与CO2浓度的关系
B. 在一定范围内,植物光合速率与光照强度的关系
C. 发生质壁分离复原的细胞吸水量与时间的关系
D. 植物呼吸速率与温度的关系
4. 经常松土能提高农作物的产量,这是因为①增强植物的呼吸作用,为矿质离子的吸收提供更多的能量;②有利于分解者的活动,提高光合作用的效率;③有利于圆褐固氮菌的活动,增加土壤的肥力,促进植物果实的成熟。④促进硝化细菌将氨态氮转化为硝态氮,提高氮肥的利用率;⑤促进根系吸收有机肥料,实现物质和能量的多级利用:
A. ①②④ B. ①②④⑤ C. ①②③⑤ D. ①③④
5. 在较强光照强度下,降低CO2浓度,下列作物中的哪两种光合作用速率下降得更快:
①棉花 ②玉米 ③高粱 ④大豆
A. ②和③ B. ①和④ C. ①和③ D. ②和④
6. 新型无机材料碳化钛(TiC),碳化硼(B4C3),氮化硅(Si3N4)等称为非氧化物陶瓷,合成这些物质需在高温条件下进行,在合成工艺中必须注意:
A. 通入充足的氧气 B. 避免与氧气接触
C. 可在氮气气氛中合成 D. 通入氟气
7. 下列说法或表示方法中正确的是:
A. 等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多
B. 氢气的燃烧热为285.8kJ · mol-1,则氢气燃烧的热化学方程式为
2H2(g) + O2(g) = 2H2O(l);△H=-285.8 kJ· mol-1
C. Ba(OH)2 · 8H2O(s) + 2NH4Cl(s) = BaCl2(s) + 2NH3(g) + 10H2O(l);△H<0
D. 已知中和热为57.3 kJ · mol-1,若将含0.5mol H2SO4的浓溶液与含1mol NaOH的溶液混合,放出的热量要大于57.3 kJ
8. 已知C3N4晶体具有比金刚石还大的硬度,且每个原子的最外层均满足8电子结构。下列关于C3N4晶体的说法正确的是:
A. C3N4晶体可能是分子晶体,晶体中微粒间通过共价键相结合
B. C3N4晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子
C. C3N4晶体中,C—N键的键长比金刚石中C—C键的键长要长
D. C3N4晶体中每个氮原子上还有2对未共用电子
9. 下列能够使反应 :Cu+2H2O=Cu(OH)2+H2↑ 获得成功的是:
A. 铜片作原电池的负极,碳棒作原电池的正极 ,氯化钠作电解质溶液
B. 铜——锌合金在潮湿的空气中发生电化学腐蚀
C. 用铜片作阴、阳电极,电解氯化钠溶液
D. 用铜片作阴、阳电极,电解硫酸铜溶液
10. 下列各组顺序不正确的是:
A. 粒子半径:S2- > Cl - > F - > Na+ > Mg2+
B. 热稳定性:SiH4 < PH3 < NH3 < H2O < HF
C. 熔点: SiO2 > NaCl > 干冰 > 碘 > 臭氧
D. 还原性:HF < HCl < HBr < HI < H2S
11. 下列除去杂质的方法正确的是
A. 除去FeCl2溶液中的少量FeCl3: 加入足量铁屑,充分反应后过滤
B. 除去CO2中的少量HCl: 通入Na2CO3溶液,收集气体
C. 除去N2中的少量O2: 通过灼热的CuO粉末,收集气体
D. 除去KCl溶液中的少量MgCl2: 加入适量NaOH溶液,过滤
12. 下列反应的离子方程式正确的是:
A. 用惰性电极电解MgCl2溶液:2Cl-+2H2O
![]() Cl2↑+H2↑+2OH
-
Cl2↑+H2↑+2OH
-
B. 向次氯酸钙溶液中通人过量CO2:ClO-+CO2+H2O = HClO+HCO3-
C. 小苏打溶液与甲酸溶液混合:HCO3-+H+ = H2O+CO2↑
D. 硫酸亚铁溶液中加入H2O2溶液:Fe2++H2O2+2H+ = Fe3++2H2O
13. 下列反应中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是:
A. NH4Cl![]() NH3↑+ HCl↑ B. Na2CO3+CO2+H2O=2NaHCO3
NH3↑+ HCl↑ B. Na2CO3+CO2+H2O=2NaHCO3
C. 2NaOH+Cl2 =NaCl+NaClO+H2O D. 2 Na2O2+2CO2=2Na2CO3+O2
二、选择题(本题包括8小题,每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得6分,选对但不全的得3分,有选错的得0分)。
14. 采用绝热(即系统不与外界交换热量)的方式使一定质量的理想气体由初态A变化至终态B,对于不同的绝热方式下列说法正确的是:
A. 对气体所做的总功不同 B. 对气体所做的总功相同
C. 对气体不需做功,因为没有热的传递 D. 以上三种说法都不对
15. 下列说法正确的是:
A. 光波是一种概率波,也是一种电磁波
B. 单色光从光密介质进入光疏介质时,光子的能量改变
C. 爱因斯坦为解释光电效应的实验规律提出了光子说
D. 爱因斯坦的质能方程为核能的开发和利用提供了理论依据
16. 质量相等的两颗人造地球卫星A和B,分别在不同轨道上绕地球做匀速圆周运动,两卫星的轨道半径分别为rA和rB,且rA>rB,则A和B两卫星比较,下列说法正确的是:
A. 卫星A受到地球引力较小 B. 卫星A的动能较大+
C. 卫星B的运动周期较大 D. 卫星A的机械能较大
17. 如图所示,当波沿着一条一端固定的绳子传播到B点的波形图,由图可判断出A点开始振动的方向是:
A. 向左 B. 向右 C. 向上 D. 向下
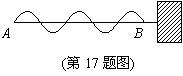 |
18.
 如图所示,A为一放在竖直轻弹簧上的小球,在竖直向下恒力F的作用下,在弹簧弹性限度内,弹簧由原长压缩到B点,现突然撒去力F,小球将向上弹起直至速度为零,则小球在上升过程中(不计空气阻力):
如图所示,A为一放在竖直轻弹簧上的小球,在竖直向下恒力F的作用下,在弹簧弹性限度内,弹簧由原长压缩到B点,现突然撒去力F,小球将向上弹起直至速度为零,则小球在上升过程中(不计空气阻力):
A. 小球,弹簧和地球组成的系统包括弹性势能在内的机械能守恒
B. 小球速度减为零时,还未脱离弹簧
C. 小球机械能逐渐增大
D. 小球动能先增大后减小
19.
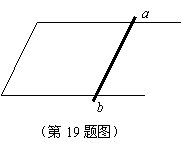 在水平面内有一固定的U型裸金属框架,框架上放置一根重金属杆ab,金属杆与框架接触电阻不计,整个装置放在竖直方向的匀强磁场中,如图所示:
在水平面内有一固定的U型裸金属框架,框架上放置一根重金属杆ab,金属杆与框架接触电阻不计,整个装置放在竖直方向的匀强磁场中,如图所示:
A. 只有当磁场方向向上且增强,ab杆才可能向左移动
B. 只有当磁场方向向下且减弱,ab杆才可能向右移动
C. 无论磁场方向如何,只要磁场减弱,ab杆才有向右移动的可能
D. 当磁场变化时,ab杆中一定有电流产生,但它不一定移动
20.
 一质量
一质量![]() 的可以看作质点的物体,受到一个变力作用,从静止做变加速度直线运动,其加速度a随时间
的可以看作质点的物体,受到一个变力作用,从静止做变加速度直线运动,其加速度a随时间![]() 的变化规律如图所示,则该物体在4.0s末的动量值为:
的变化规律如图所示,则该物体在4.0s末的动量值为:
A. 30kg·m/s
B. 40kg·m/s
C. 80kg·m/s
D. 20kg·m/s
21. A、B两小球在光滑水平面上沿同一直线向同一方向运动,A球的动量为5kg·m/s,B球的动量为7kg·m/s,当A球追上B球时发生对心碰撞,则碰撞后A、B两球动量的可能值为:
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
 第II卷(非选择题,共174分)
第II卷(非选择题,共174分)
三、非选择题。
22. (17分)
(1)(8分)测一小球直径时,螺旋测微器的示数如图所示,可知该小球的直径为_____mm,若将可动刻度再顺时针转过72°(从右往左看),则读数为____mm。
(2)(9分)在“研究弹力和弹簧伸长的关系”的实验中,某同学将弹簧的一端固定在铁架台上,另一端挂一只小盘,铁架台的竖直杆上固定一个可以上下移动的标志物,作为计时标志,让小球在竖直方向离开平衡位置放手后,小盘在竖直方向做简谐运动(此装置也称竖直弹.簧振子),如图所示,这位同学想用在“探究弹力和弹簧伸长的关系”的实验中所学的科学方法,探究此竖直弹簧振子做简谐运动的周期T与质量m的关系。
一、实验中改变小盘中砝码的质量,(设盘和盘中砝码的总质量为m),测量其全振动50次的时间t并求出相应的周期T,实验中得到的数据如下表:
| m/×10-3kg | 5 | 10 | 15 | 20 | 25 |
| t/s | 0.80 | 1.13 | 1.38 | 1.60 | 1.79 |
二、数据处理(完成下列填空)
(1)以质量m为横坐标,周期T为纵坐标,根据所测数据在坐标纸上描点,并按照图纸中各点的分布与走向,尝试作出一条平滑的曲线(包括直线);从图中可以看出图线是一条________(填“直线”或“曲线”);
(2)若以m为横坐标,__为纵坐标,重新作出图线;从图中可以看出这是一条过原点的直线;
(3)假设(2)中图线斜率为b,写出弹簧振子做简谐运动周期T与质量m的关系式为T=_____
23.
 (18分)如图所示,abcd为一正方形区域,正离子束从a点沿ad方向以一定速度射入,若在该区域中加上一个沿ab方向的匀强电场,电场强度为E,则离子束刚好从c点射出;若撒去电场,在该区域中加上一个垂直于abcd平面向外的匀强磁砀,磁感应强度为B,则离子束也刚好从c点射出,设离子束之间的相互作用可忽略,试求离子入射速度
(18分)如图所示,abcd为一正方形区域,正离子束从a点沿ad方向以一定速度射入,若在该区域中加上一个沿ab方向的匀强电场,电场强度为E,则离子束刚好从c点射出;若撒去电场,在该区域中加上一个垂直于abcd平面向外的匀强磁砀,磁感应强度为B,则离子束也刚好从c点射出,设离子束之间的相互作用可忽略,试求离子入射速度![]() 的大小。
的大小。
24. (15分)如图所示,AB,BC,CD和DE为质量可略的等长细线,长度均为5米,A,E端悬挂在水平天花板上,AE=14米,B,D是质量均为mo=7千克的相同小球。质量为m的重物挂于C点,平衡时C点离天花板的垂直距离为7米。试求重物质量m.
 |
25.
 (22分)如图所示,一块质量为M、长为l的匀质板放在很长的光滑水平桌面上,板的左端有一质量为m的物块,物块上连接一根很长的细绳,细绳跨过位于桌面边缘的定滑轮,某人以恒定的速度
(22分)如图所示,一块质量为M、长为l的匀质板放在很长的光滑水平桌面上,板的左端有一质量为m的物块,物块上连接一根很长的细绳,细绳跨过位于桌面边缘的定滑轮,某人以恒定的速度![]() 向下拉绳,物块最多只能到达板的中点,而且此时板的右端尚未到达桌边定滑轮。求
向下拉绳,物块最多只能到达板的中点,而且此时板的右端尚未到达桌边定滑轮。求
(1)物块与板的动摩擦因数及物块刚到达板的中点时板的位移;
(2)若板与桌面间有摩擦,为使物块能达到板的右端,板与桌面的动摩擦因数的范围;
(3)若板与桌面间的动摩擦因数取(2)问中的最小值,在物块从板的左端运动到右端的过程中,人拉绳的力所做的功(其他阻力均不计)。
26. (16分)已知A、B、C、D均为短周期元素,且原子序数依次递增;A、B、C三种元素的核电荷数之和等于D元素的核电荷数,且D元素的核电荷数为C的2倍;C、D两元素同主族,且能在一定条件下发生下面两个反应
①化合物(只含A、B)跟化合物(只含B、C)按物质的量比2:3反应生成单质(含B)和化合物(只含A、C)
②化合物(只含A、D)跟化合物(只含C、D) 按物质的量比2:1反应生成单质(含D)和化合物(只含A、C)
请通过分析后回答:
⑴B元素的名称是________________,C元素的原子结构示意图为__________________
⑵D元素最高价氧化物的水化物的化学式是_______,反应①中的化合物(只含A、B)分子的空间构型为____________________
⑶反应②的化学方程式为______________,其中每生成单质D 32g,反应中有_____ mol电子转移。
⑷含有这四种元素(四种元素都含有)的各种化合物中,相同浓度下,溶液的pH最小的化合物的化学式为_________,该化合物的晶体中阳离子与阴离子的个数比为___________________。
27. (14分)已知A为酸式盐,B为某二价主族金属(其原子序数不超过20)的化合物,常温常压下C、D、F、G、I均呈气态,H为无色液体。等物质的量的A、B充分混合后加热能恰好完全反应(如下图所示),E的式量为100,G的式量比F大16。图中反应条件(除加热外)均已略去。
 |
⑴写出B的电子式________________ I的结构式 。
⑵写出下列反应的离子方程式:
①向A溶液中加入过量的NaOH溶液,并加热 ,
②气体I通入B溶液中 ,
⑶写出C和D反应的化学方程式 .
⑷如对盛有气体G的密闭容器(带可移动的活塞)进行压缩操作,产生的现象是______ ____________________________________ ,原因是_______________________________ _____________________________________________________________________。
28.
 (18分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:
(18分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:
⑴B是用来收集实验中产生的气体的装置,但未将导管画全,请在答题卡上相应图中把导管补充完整。
⑵实验中他们取6.4 g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:_________________________________。
②为什么有一定量的余酸但未能使铜片完全溶解?你认为原因是:_______________________________________________________________________。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:______________(填写字母编号)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
⑶为定量测定余酸的物质的量浓度,甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度,他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是_________________(填写字母编号)。
A.将装置A产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥,称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥,称量沉淀
②乙学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL于锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知:Cu(OH)2开始沉淀的pH约为5),通过测出消耗NaOH溶液的体积来求余酸的物质的量浓度。
假定反应前后烧瓶中溶液的体积不变,你认为乙学生设计的实验方案能否求得余酸的物质的量的浓度_______(填“能”或“否”),其理由是________________________ ____________________________________________。
(4)请再设计一个可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)。
29. (14分)向盛有400mL某浓度稀HNO3的大烧杯中加入Wg铁粉,充分反应后,铁粉质量减少16.8g,再往烧杯中加入V mL 4 mol·L-1的稀硫酸,充分反应后,铁粉质量又减少8.4g,此时铁粉仍有剩余,(假设稀HNO3只被还原为NO)
⑴写出题中铁粉与稀HNO3反应的离子方程式___________________________________,通过计算得出所用的稀HNO3的物质的量浓度为_______________ mol·L-1,加稀H2SO4之前,溶液中剩余的NO3-的物质的量为___________mol。
⑵加入4 mol·L-1的稀硫酸的体积V =_______________________
⑶若硫酸足量,要使反应有H2产生,W的取值范围是_______________________。
[注:28题第1小题在制作答题卡时请将实验装置图原样复制到答题卡相应位置上]
30. 下图为种子萌发过程中物质的转化情况示意图,请据图分析有关问题:
 |
(1)种子萌发初期,种子中的有机物在酶的作用下被水解为简单的有机物并运送到正在生长的幼胚中去。若上述种子为大豆种子,则在种子萌发中_______________等酶会大量形成;此时种子内有机物干重和种类将发生的变化是________________。
(2)种子萌发过程中形成的糖一部分要参与新器官细胞壁的形成,与这一过程有关的细胞结构是__________。
(3)上述图中糖分解形成的有机酸最可能是_____,它的形成部位是细胞的_____。
(4)由糖形成新的氨基酸需发生的代谢过程是_____,在人体内不能由上述过程形成的氨基酸称为_____,之所以不能由上述过程形成是由于人体内_______________。
31. 根据提供的实验材料和用具,简要写出第二步及以后的试验结果,验证细胞膜的选择透过性功能。
试验材料和用具:
①新鲜的红玫瑰花瓣,②烧杯,③记号笔,④清水,⑤质量分数为15%的盐酸溶液,⑥量筒。
第一步:选择两个大小相同的烧杯,用记号笔标上A,B.
第二步:_________________________________。
第三步:_________________________________。
实验结果:________________________________。
结果分析:________________________________。
湖北省部分重点中学2006届高三第一次联考
理综参考答案
1. C 2. C 3. D 4. A 5. B 6. B
7. D 8. B 9. C 10. C 11. A 12. B
13. D 14. B 15. ACD 16. AD 17. C 18. AD
19. CD 20. B 21. BC
22、(1)10.992 4分 10.892 4分(2)①曲线 3分 T2 3分 ②![]() 3分
3分
23、解:设正离子质量为m,电量为![]() ,沿ad方向以vo射入,设正方形abcd的边长为l:
,沿ad方向以vo射入,设正方形abcd的边长为l:
沿cd方向加匀强电场E,离子在电场力的作用下做类平抛运动。
沿ab方向有:![]() ①
3分
①
3分
![]() ②
2分
②
2分
沿ad方向有:![]() ③ 3分
③ 3分
由①②③消t得:![]() ④ 2分
④ 2分
撒去电场加磁场B,离子做匀速圆周运动,为使离子从c点射出,要求圆半径![]() 故有
故有
![]() ⑤ 2分
⑤ 2分
由④⑤式得:![]() /2B ⑥ 3分
/2B ⑥ 3分
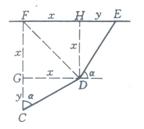 24、解:由题图中左右对称。如图①考虑右半侧有:
24、解:由题图中左右对称。如图①考虑右半侧有:
![]()
![]() △
△![]() 与△FDE全等,故虚线FD两侧的图形对称,
与△FDE全等,故虚线FD两侧的图形对称,
![]() ,由
,由![]() ,
,
解得:![]() 3/5 ① 4分
3/5 ① 4分
|
由C点受力平衡有
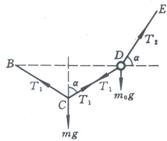
![]() ② 3分 ①
② 3分 ①
代入②得:![]() ③
③
由D点受力平衡有:![]() ④ 2分
④ 2分
|
把![]() 3/5,
3/5,![]() 4/5代入得 :
4/5代入得 :![]()
![]()
解出![]() ⑥
⑥
故![]()
即![]() ⑦ 4分
⑦ 4分
25、(1)设物块在板上滑行的时间为![]() ,对板应用动量定理得
,对板应用动量定理得
(7分)
![]() 2分 ∴
2分 ∴![]() ①
①
设在此过程中物块前进位移为![]() ,板前进位移为
,板前进位移为![]() ,
,
则![]() ②
1分
②
1分
![]() ③
1分
③
1分
![]() ④
1分
④
1分
由①②③④得:![]() 1分
1分
![]() 1分
1分
故物块与板间的摩擦因数为![]() ,物块到达板的中点时,板的位移
,物块到达板的中点时,板的位移![]() 。
。
(2)设板与桌面间摩擦因数为![]() ,物块在板上滑行的时间为
,物块在板上滑行的时间为![]() 则对板应用动量定理得
则对板应用动量定理得
(8分 )
![]()
![]() 3分
3分
又设物块从板的左端运动到右端的时间为![]()
则![]()
![]() 2分
2分
为了使物块能到达板的右端,必须满足![]() 1分
1分
即![]()
![]() 2分
2分
所以为了使物块能到达板的右端,板与桌面间的摩擦因数![]()
(3)设绳子的拉力为T,物块从板的左端到达右端的过程中物块的位移为![]() ,则有
,则有
(7分)
![]() 2分
2分
![]() 2分
2分
所以由功的计算公式得:
![]() 3分
3分
所以在物块从板的左端到达板的右端的过程中,绳的拉力做功为![]() 。
。
(或![]() △
△![]() △E+W
△E+W![]() )
)
(注:用牛顿运动定律及运动学公式解答或用其它方法解答,只要正确,同样给分)
26.(16分)每空2分
(1)氮 ;O 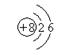 (2)H2SO4 ;
三角锥形
(2)H2SO4 ;
三角锥形
(3)2H2S +SO 2=3S+2H2O ;4/3 (4)NH4HSO4 1:1
27.(14分)
(1)[H ![]() ] -Ca2+[
] -Ca2+[![]() H ] – (2分) O=C=O (2分)
H ] – (2分) O=C=O (2分)
(2)①NH4++HCO3-+2OH -![]() CO32-+2H2O+NH3↑(2分)
CO32-+2H2O+NH3↑(2分)
![]() ②CO2 +Ca2++2OH -=CaCO3↓+H2O (2分)
②CO2 +Ca2++2OH -=CaCO3↓+H2O (2分)
(3)4 NH3+5O2 4NO+6H2O (2分)
(4)气体颜色先变深,再逐渐变浅(2分);压缩容器将使有色气体NO2浓度增大,颜色加深,又因平衡2 NO2 ![]() N2O4 向右移动,颜色变浅(2分)。
N2O4 向右移动,颜色变浅(2分)。
28.(18分)
(1)作图时B装置中导气管长进短出 (2分)
(2)①Cu+2H2SO4(浓)![]() CuSO4+SO 2↑+2H2O(2分)
CuSO4+SO 2↑+2H2O(2分)
②反应过程中浓H2SO4被不断消耗,生成的水逐渐增多,使浓硫酸逐渐变稀,至一定浓度就不再与铜片反应(2分)
③AD(2分)
(3)①ABC(3分) ②否(2分),因为Cu2+的蓝色会干扰滴定终点的正确判断(2分)
(4)方案一:反应结束后将烧瓶中的铜片取出,洗净、烘干,称其质量即可;
方案二:反应结束后将烧瓶中的铜片取出,然后向溶液中加入足量氯化钡溶液,过滤出沉淀,洗净、干燥后称量。
方案三:反应结束后将烧瓶中的铜片取出,然后向溶液中加入足量氢氧化钠溶液,过滤出沉淀,洗净、干燥后称量。(以上方案供参考,答题时任写一种合理方案即可。3分)
29.(14分)
(1)3Fe +8H+ +2NO3-=3Fe2++2 NO↑+4H2O(2分),2(3分),0.6(3分)
(2)50.0(3分)
(3)W>67.2(3分)
30.蛋白酶,淀粉酶,脂肪酶(只答一个就行) 干重减轻,有机物的种类增多。
高尔基体。 丙酮酸。 细胞质基质。 氨基转换作用。 必需氨基酸。
糖类分解时不能产生与必需氨基酸相对应的中间产物。(每空3分,共24分)
31. 第二步:在A,B两烧杯中分别放入等量15%的盐酸溶液或清水。
第三步:取等量的红玫瑰花瓣,分别放入A,B烧杯中。过一段时间后观察。
清水中的花瓣仍为红色,水无色。盐酸溶液中的花瓣逐渐退色,溶液变红。
盐酸溶液使细胞膜失去了选择透过性,结果大分子色素能通过原生质层进入盐溶液 使溶液变红。(每空4分,共16分)